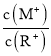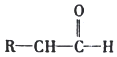题目内容
【题目】最近雾霾天气肆虐我国大部分地区。其中![]() 是造成空气污染的主要原因,利用钠碱循环法可除去
是造成空气污染的主要原因,利用钠碱循环法可除去![]() 。
。
![]() 钠碱循环法中,吸收液为
钠碱循环法中,吸收液为![]() 溶液中各离子浓度由大到小的顺序为_____________。
溶液中各离子浓度由大到小的顺序为_____________。
![]() 溶液吸收
溶液吸收![]() 反应的离子方程式是__________________________________。
反应的离子方程式是__________________________________。
![]() 已知
已知![]() 的电离常数为
的电离常数为![]() ,
,![]() ;
;![]() 的电离常数为
的电离常数为![]() ,
,![]() ,则下列微粒可以大量共存的是______
,则下列微粒可以大量共存的是______![]() 填序号
填序号![]() 。
。
A.![]() 和
和![]()
![]() 和
和![]()
![]() 和
和![]()
![]() 和
和![]()
![]() 吸收液吸收
吸收液吸收![]() 的过程中,水溶液中
的过程中,水溶液中![]() 、
、![]() 、
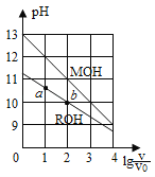
、![]() 随pH的分布如图:
随pH的分布如图:

![]() 吸收
吸收![]() 制备
制备![]() 溶液,实验中确定何时停止通
溶液,实验中确定何时停止通![]() 的实验操作为_________________。
的实验操作为_________________。
![]() 在
在![]() 溶液中离子浓度关系不正确的是_______
溶液中离子浓度关系不正确的是_______![]() 填序号
填序号![]() 。
。
A.![]()
![]()
C.![]()
![]()
![]() 亚硫酰氯
亚硫酰氯![]() 又名氯化亚砜,是一种液态的非电解质,沸点为
又名氯化亚砜,是一种液态的非电解质,沸点为![]() 。
。![]() 中氯元素与硫元素直接以共价键相连,其中Cl呈
中氯元素与硫元素直接以共价键相连,其中Cl呈![]() 价;
价;![]() 遇水可生成
遇水可生成![]() 。请回答下列问题:蒸干
。请回答下列问题:蒸干![]() 溶液不能得到无水
溶液不能得到无水![]() ,若将
,若将 ![]() 与
与![]() 混合并加热,可制得无水
混合并加热,可制得无水![]() ,请用
,请用 ![]() 与水反应的方程式和必要的文字描述解释原因________________________________________________________。
与水反应的方程式和必要的文字描述解释原因________________________________________________________。
【答案】![]()
![]()
![]() 测量溶液的pH,若pH约为4,停止通
测量溶液的pH,若pH约为4,停止通![]()
![]()
![]() ,随着
,随着![]() 的通入,能够消耗
的通入,能够消耗![]() 分解产生的水,同时生成的HCl抑制了
分解产生的水,同时生成的HCl抑制了![]() 的水解
的水解
【解析】
(1)![]() 属于强碱弱酸盐,根据盐类水解规律,可得溶液中离子浓度大小关系。
属于强碱弱酸盐,根据盐类水解规律,可得溶液中离子浓度大小关系。
(2)![]() 溶液吸收
溶液吸收![]() 生成NaHSO3。
生成NaHSO3。
(3)根据电离常数可排出H2SO3、H2CO3、HSO3-、HCO3-的酸性强弱顺序,根据强酸可以制取弱酸的规律,可以判断给出的四组微粒间能否发生反应。
(4)![]() 由图象可知,当溶液pH约为4时,可完全反应生成
由图象可知,当溶液pH约为4时,可完全反应生成![]() ,此时可停止通入二氧化硫,故可通过测量溶液pH的方法控制何时停止通
,此时可停止通入二氧化硫,故可通过测量溶液pH的方法控制何时停止通![]() 。
。
![]() 利用盐溶液中的物料守恒、电荷守恒、质子守恒判断。
利用盐溶液中的物料守恒、电荷守恒、质子守恒判断。
(5)亚硫酰氯![]() 与水发生水解反应:
与水发生水解反应:![]() ,生成的HCl可以抑制Mg2+的水解。
,生成的HCl可以抑制Mg2+的水解。
![]() 属于强碱弱酸盐,根据盐类水解规律,可得溶液中离子浓度大小关系为:
属于强碱弱酸盐,根据盐类水解规律,可得溶液中离子浓度大小关系为:![]() ,
,
故答案为:![]() ;
;
![]() 工业上常用
工业上常用![]() 溶液来吸收
溶液来吸收![]() ,反应生成亚硫酸氢钠,该反应的离子方程式是:
,反应生成亚硫酸氢钠,该反应的离子方程式是:![]() ,
,
故答案为:![]() ;
;
![]() 已知Ka越大酸性越强,故酸性强弱顺序为:H2SO3>H2CO3>HSO3->HCO3-,酸性较强的酸能与酸性较弱的酸根离子反应,所以
已知Ka越大酸性越强,故酸性强弱顺序为:H2SO3>H2CO3>HSO3->HCO3-,酸性较强的酸能与酸性较弱的酸根离子反应,所以![]() 与
与![]() 不反应,
不反应,![]() 与
与![]() 不反应,即BC能共存,
不反应,即BC能共存,
故答案为:BC;
![]() 由图象可知,当溶液pH约为4时,可完全反应生成
由图象可知,当溶液pH约为4时,可完全反应生成![]() ,此时可停止通入二氧化硫,故可通过测量溶液pH的方法控制,
,此时可停止通入二氧化硫,故可通过测量溶液pH的方法控制,
故答案为:测量溶液的pH,若pH约为4,停止通![]() ;
;
![]() 在
在![]() 溶液中,电离程度大于水解程度,溶液显酸性,
溶液中,电离程度大于水解程度,溶液显酸性,
A.由物料守恒可知,![]() ,故A错误;
,故A错误;
B.根据质子守恒,![]() ,故B正确;
,故B正确;
C.在![]() 溶液中,电离程度大于水解程度,溶液显酸性,则离子浓度为
溶液中,电离程度大于水解程度,溶液显酸性,则离子浓度为![]() ,故C正确;
,故C正确;
D.根据电荷守恒![]() ,故D正确;
,故D正确;
故答案为:A;
![]() 蒸干
蒸干![]() 溶液时,
溶液时,![]() 会发生水解生成
会发生水解生成![]() ,且生成的HCl具有挥发性,当
,且生成的HCl具有挥发性,当![]() 与
与![]() 混合共热时,由于
混合共热时,由于![]() 极易与水反应,反应产生的HCl可以抑制
极易与水反应,反应产生的HCl可以抑制![]() 的水解,
的水解,
故答案为:![]() ,随着
,随着![]() 的通入,能够消耗
的通入,能够消耗![]() 分解产生的水,同时生成的HCl抑制了
分解产生的水,同时生成的HCl抑制了![]() 的水解。
的水解。