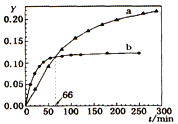
题目内容
【题目】下列关于各图像的解释或结论正确的是( )
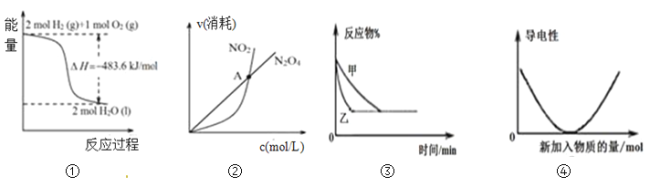
A.图①可知:热化学方程式是H2(g)+1/2O2(g)=H2O(g)△H=﹣241.8kJ/mol
B.图②可知:对于恒温恒容条件下的反应2NO2(g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C.图③可表示:压强对2A(g)+2B(g)![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
D.图④可表示:Ba(OH)2溶液中滴加稀硫酸,溶液导电性的变化
【答案】D
【解析】
试题分析:图①可知:热化学方程式是H2(g) +1/2O2(g) = H2O(l) △H=﹣241.8 kJ/mol,故A错误;速率不变时平衡,A点反应速率有变化,A点不是平衡状态,故B错误;对2A(g) + 2B(g) ![]() 3C(g) +D(s),增大压强平衡正向移动,反应物的含量减小,故C错误;Ba(OH)2溶液中滴加稀硫酸,溶液中离子浓度先减小后增大,溶液导电性先减弱后增强,故D正确。
3C(g) +D(s),增大压强平衡正向移动,反应物的含量减小,故C错误;Ba(OH)2溶液中滴加稀硫酸,溶液中离子浓度先减小后增大,溶液导电性先减弱后增强,故D正确。

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目