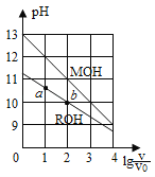
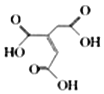
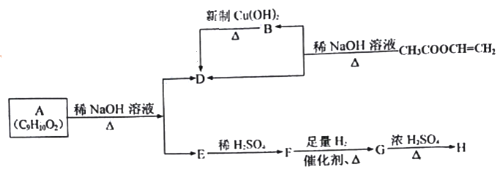
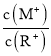题目内容
【题目】某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量SiO2、Fe的氧化物)为原料制备碳酸镁晶体(MgCO33H2O)。实验过程如下:

下列说法不正确的是( )
A.为了加快酸溶速率,可将原料进行研磨并适当提高反应温度
B.滤渣的主要成分是H2SiO3和SiO2
C.萃取后,可用KSCN溶液检验水相中是否含有Fe3+
D.萃取后,往水溶液中加入适量的Na2CO3,经过加热蒸发,可得到碳酸镁晶体
【答案】D
【解析】
A.废渣是固体,由于固体表面积越大,反应速率越快,反应温度越高,速率越快,所以为了加快酸溶速率,可将原料进行研磨并适当提高反应温度,A正确;
B.工业废渣是主要成分为MgCO3、MgSiO3和少量SiO2、Fe的氧化物,加入40%稀H2SO4后,MgCO3、MgSiO3与稀硫酸反应产生MgSO4及H2SiO3沉淀,Fe的氧化物与稀硫酸反应产生可溶性的FeSO4、Fe2(SO4)3,SiO2与硫酸不能发生反应,所以滤渣的主要成分是H2SiO3和SiO2,B正确;
C.向过滤后的滤液中加入H2O2可以将Fe2+氧化为Fe3+,加入有机萃取剂,得到Fe3+的有机萃取液,Mg2+存在于水溶液中,萃取后,若水中含有Fe3+,可根据Fe3+与SCN-反应变为血红色溶液,用KSCN溶液检验水相中是否含有Fe3+,C正确;
D.萃取后,往水溶液中加入适量的Na2CO3,溶液中含有MgSO4,二者反应产生MgCO3沉淀,在50℃下干燥,得到碳酸镁晶体,D错误;
故合理选项是D。

练习册系列答案
相关题目