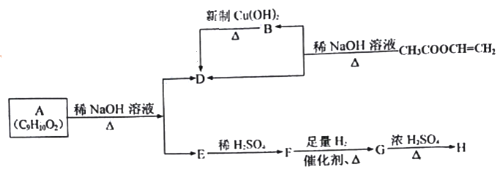
题目内容
【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
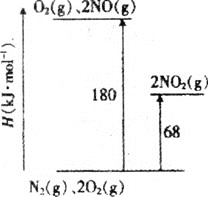
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2molNO2的能量变化)。1molNO氧化为NO2的焓变ΔH=___。
(2)某温度下,反应的平衡常数如下:
a.2NO2(g)N2(g)+2O2(g) K=6.7×1016
b.2NO(g)N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是___(填“a”或“b”);反应2NO(g)+O2(g)2NO2(g)的K=___(保留三位有效数字)。
(3)已知反应2NO(g)+O2(g)2NO2的正反应速率v正=k1cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
起始浓度/molL-1 | |||
组别 | NO | O2 | 初始速率 /molL-1s-1 |
1 | 0.02 | 0.0125 | 7.98×10-3 |
2 | 0.02 | 0.0250 | 15.96×10-3 |
3 | 0.04 | 0 0125 | 31.92×10-3 |
则k1=___,m=___,n=___。
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是___(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第一步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
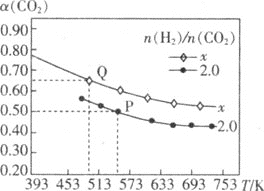
(5)一定条件下测得容器中NO、O2、NO2浓度发生如图变化。
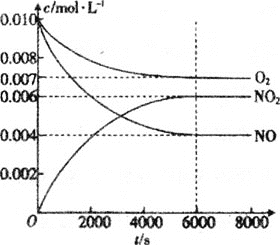
①NO的平衡转化率为___。
②该温度下反应2NO(g)+O2(g)2NO2(g)的平衡常数为___(保留整数)。
【答案】-56kJmol-1 b 3.28×1013 1596L2mol-2s-1 2 1 AC 60% 321
【解析】
(1)图1中是2molNO完全反应被氧化为二氧化氮放出热量180KJ-68KJ=112KJ,1moI NO氧化为NO2的放出热量为56KJ,据此得到;
(2)a.2NO2(g)=N2(g)+2O2(g) K=6.7×1016;b.2NO(g)=N2(g)+O2(g) K=2.2×1030;平衡常数越大,分解反应趋势较大,利用反应的平衡常数计算得到2NO(g)+O2(g)=2NO2(g)反应的平衡常数;
(3)正反应速率v正=k1cm(NO)cn(O2),1、2组NO浓度相等,但是氧气浓度不等,据此计算n;1、3组氧气浓度相等,NO浓度不等,则![]() =(
=(![]() )m,据此计算m;根据v正=kxm(NO)cn(O2)及NO浓度、氧气浓度、m、n计算k1;
)m,据此计算m;根据v正=kxm(NO)cn(O2)及NO浓度、氧气浓度、m、n计算k1;
(4)A.2NO(g)+O2(g)2NO2(g)的平衡常数K1= ![]() ,第一步:NO+NO=N2O2快速平衡,K=
,第一步:NO+NO=N2O2快速平衡,K= ![]() ,第二步:N2O2+O2=2NO2慢反应,K2=
,第二步:N2O2+O2=2NO2慢反应,K2= ![]() ,据此计算判断;
,据此计算判断;
B.第一步反应快;
C.活化能越高反应越难进行;
D.第二部反应慢,碰撞不是100%有效;
(5)①图象分析可知NO消耗浓度=0.01mol/L-0.004mol/L=0.006mol/L,转化率=![]() ×100%;
×100%;
②平衡常数K=![]() 。
。
![]() 图中表示生成
图中表示生成![]() 的能里变化,
的能里变化,![]() ;
;
![]() ;
;
由盖斯定律,![]() 得
得![]() ,两边同除以2得:
,两边同除以2得:![]() ;
;
故答案为:-56kJmol-1;
![]() 平衡常数越大,反应越容易进行,b反应的平衡常数K大,所以分解反应趋势较大的反应是b;由
平衡常数越大,反应越容易进行,b反应的平衡常数K大,所以分解反应趋势较大的反应是b;由![]() 得,
得,![]() ;故答案为:b;
;故答案为:b;![]() ;
;
![]() 浓度不变时,氧气的浓度增大1倍,速率也增大1倍,故
浓度不变时,氧气的浓度增大1倍,速率也增大1倍,故![]() ;由组1和3,NO的浓度增大1倍,速率变为原来的4倍,故
;由组1和3,NO的浓度增大1倍,速率变为原来的4倍,故![]() ;将m和n代入第1组数据,
;将m和n代入第1组数据,![]() ,解得K1=1596L2mol-2s-1;故答案为:1596L2mol-2s-1;2;1;
,解得K1=1596L2mol-2s-1;故答案为:1596L2mol-2s-1;2;1;
![]() 第一步反应的平衡常数
第一步反应的平衡常数![]() ,平衡时,
,平衡时,![]() 正
正![]() 逆
逆![]() ,得
,得![]() ,
,![]() ,故A正确;
,故A正确;
B.![]() 第一步的正反应
第一步的正反应![]() 是快反应,
是快反应,![]() 第二步的反应
第二步的反应![]() 是慢反应,
是慢反应,![]() 第一步的正反应
第一步的正反应![]() 第二步的反应
第二步的反应![]() ,故B错误;
,故B错误;
C.第二步的反应难,活化能高,第二步的活化能比第一步的活化能高,故C正确;
D.第二步是慢反应,说明![]() 与
与![]() 的有效碰撞的几率较小,不可能达到
的有效碰撞的几率较小,不可能达到![]() ,故D错误;
,故D错误;
故答案为:AC;
![]() 的平衡转化率
的平衡转化率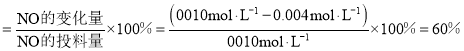 ;故答案为:
;故答案为:![]() ;
;
![]() 该温度下反应,
该温度下反应,![]() 的平衡常数
的平衡常数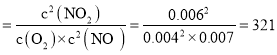 ;
;
故答案为:321。