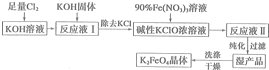
题目内容
5.在容积一定的密闭容器中,反应2A?B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )| A. | 正反应是吸热反应,且A不是气态 | B. | 正反应是放热反应,且A不是气态 | ||
| C. | 正反应是吸热反应,且A是气态 | D. | 正反应是放反应,且A是气态 |
分析 根据外界条件(浓度、温度、压强)对化学平衡的影响,可以根据平衡移动原理,利用公式ρ=$\frac{m}{V}$,根据容器内气体的密度增大,来判断容器内气体的密度是否增大进行分析.
解答 解:因温度升高,平衡向吸热的方向移动,若正反应是吸热反应,平衡正向移动,如果A为气态时,根据ρ=$\frac{m}{V}$,m不变,V不变,所以密度不会改变;如果A不是气态时,根据ρ=$\frac{m}{V}$,m变大,V不变,所以密度不大,所以A正确,C错误;
因温度升高,平衡向吸热的方向移动,若正反应是放热反应,平衡逆向移动,如果A为气态时,根据ρ=$\frac{m}{V}$,m不变,V不变,所以密度不变;如果A不是气态时,根据ρ=$\frac{m}{V}$,m变小,V不变,所以密度变小,所以B错误,D错误;
故选A.
点评 本题考查化学平衡,解答本题的关键是熟悉外界条件(浓度、温度、压强)对化学平衡的影响,注意条件的适用范围,然后再根据化学平衡移动原理来对问题做出正确的判断即可,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列说法正确的是( )
| A. | NaHSO4溶液中,c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 室温时水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量共存 | |
| C. | 等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① | |
| D. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大值时发生反应的离子方程式:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
16.下列关于乙酸与乙醇的说法正确的是( )
| A. | 互为同分异构体 | B. | 都能氧化为乙醛 | ||
| C. | 水溶液均显酸性 | D. | 可用石蕊溶液加入鉴别 |
5.两个体积相同的容器,一个盛有二氧化硫,一个盛有杂质为水蒸气的二氧化碳,在同温(120℃以上)同压(小于1个标准大气压)下,两容器内的气体一定相同的是( )
| A. | 质子总数 | B. | 质量 | C. | 密度 | D. | 原子总数 |
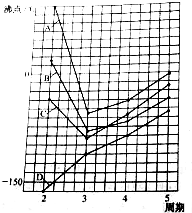 图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.
图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素气态氢化物的沸点.其中表示ⅥA族元素气态氢化物沸点的是曲线A,表示ⅣA族元素气态氢化物沸点的是曲线D;同一族中第4、5周期元素气态氢化物的沸点明显高于第3周期元素气态氢化物的沸点,其原因是同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.