题目内容
15.下列说法正确的是( )| A. | NaHSO4溶液中,c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 室温时水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量共存 | |
| C. | 等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>① | |
| D. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大值时发生反应的离子方程式:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
分析 A.根据硫酸氢钠溶液中的电荷守恒判断;
B.室温时水电离出来的c(H+)=10-13mol/L的溶液为酸或碱溶液,若为酸溶液,硝酸根离子在酸性条件下能够氧化碘离子;
C.碳酸盐溶液中碳酸根离子浓度较大,碳酸溶液中碳酸根离子浓度最小;
D.当硫酸根离子完全沉淀时,生成沉淀的质量达到最大,此时铝离子完全转化成偏铝酸根离子.
解答 解:A.NaHSO4溶液中,根据电荷守恒可得:c(Na+)+c(H+)=2c(SO42-)+c(OH-),故A错误;
B.室温时水电离出来的c(H+)=10-13mol/L的溶液可能为酸溶液,酸溶液中,NO3-、I-能够发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.②④为碳酸盐,其溶液中碳酸根离子浓度比其它该溶液都大,由于④发生互促水解,水解程度较大,则碳酸根离子浓度②>④;①为二元弱酸,c(CO32-)最小,则溶液中c(CO32-)的大小关系为:②>④>③>①,故C正确;
D.在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大值时,硫酸根离子完全生成硫酸钡沉淀,正确的离子方程式为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O,故D错误;
故选C.
点评 本题考查了离子浓度大小比较、盐的水解原理及其应用、离子方程式书写判断等知识,题目难度中等,试题知识点较多,充分考查学生灵活应用基础知识的能力,注意明确电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法,掌握盐的水解原理及其应用.

练习册系列答案
 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
5.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 12克金刚石中含有的C-C键数目为为4NA | |
| B. | 1 L 0.1 mol•L-1 NH4Cl溶液中含有0.1NA个NH4+ | |
| C. | 常温常压下,22.4L乙烯与丙烯的混合物中含有的分子数目为NA | |
| D. | 常温常压下,Na2O2与足量H2O反应生成0.2molO2,转移电子的数目为0.4NA |
6.已知某强酸性的溶液中存在大量的NO3-,下列有关该溶液中还存在的物质叙述正确的是( )
| A. | 铝元素能以Al3+或AlO2-的形式存在 | |
| B. | 铁元素能以Fe2+和Fe3+的形式共存 | |
| C. | 硫元素主要以SO42-的形式存在 | |
| D. | 氯元素能以Cl-或ClO-的形式存在 |
3.如图表示从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法合理的是( )
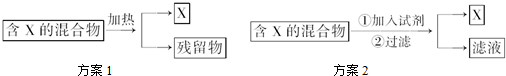

| A. | 可以选用方案1分离碳酸氢钠中含有的氯化铵 | |
| B. | 方案1中残留物可以受热不易挥发 | |
| C. | 方案2中加入的试剂一定能够与除X外的物质发生化学反应 | |
| D. | 方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3. |
10.25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如表:
下列判断不正确的是( )
| 实验编号 | 起始浓度/mol•L | 反应后溶液的pH | |
| c(HA) | c(NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | X | 0.05 | 7 |
| A. | X>0.05 | |
| B. | 将实验①所得溶液加水稀释后,c(OHˉ )/c(A-)变大 | |
| C. | 实验①所得溶液c(A-)+c(HA)=0.10mol•L-1 | |
| D. | 实验②所得溶液:c(Na+)+c(OH-)=c(A-)+c(H+) |
20.国务院颁布的《“十二五”控制温室气体排放工作方案》提出,2015年我国单位国内生产总值CO2排放要比2010年下降17%.下列说法不正确的是( )
| A. | CO2属于酸性氧化物 | |
| B. | CO2是导致酸雨发生的主要原因 | |
| C. | 可用Na2CO3溶液捕捉(吸收)CO2 | |
| D. | 使用氢能源替代化石燃料可减少CO2排放 |
7.图象能直观地反映有关物理量的变化及规律,下列各图象与描述相符的是( )
| A. | 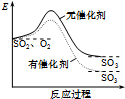 如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 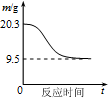 如图表示0.1 mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| C. | 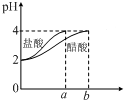 如图表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100 | |
| D. | 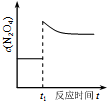 如图表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
4.下列有关氨及氨水的说法中,正确的是( )
| A. | NH3是10电子分子,具有还原性 | B. | 液氨、氨气、氨水是同一种物质 | ||
| C. | 氨气是非电解质,氨水是电解质 | D. | NH3•H2O是混合物 |
5.在容积一定的密闭容器中,反应2A?B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
| A. | 正反应是吸热反应,且A不是气态 | B. | 正反应是放热反应,且A不是气态 | ||
| C. | 正反应是吸热反应,且A是气态 | D. | 正反应是放反应,且A是气态 |