题目内容
下列反应属于吸热反应的是
| A.碳与水蒸气制水煤气的反应 | B.生石灰和水的反应 |
| C.盐酸与氢氧化钠溶液的反应 | D.木炭在氧气中燃烧 |
A
解析试题分析:A、碳与水蒸气反应属于吸热反应,正确;B、生石灰溶于水放出大量的热,属于放热反应,错误;C、酸碱中和反应属于放热反应,错误;D、木炭的燃烧属于放热反应,不属于吸热反应,错误。
考点:常见的吸热反应。

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
已知:H+(aq) + OH—(aq)=H2O(l) △H=—57.3kJ/mol。向1L 0.5mol/L的NaOH溶液中加入下列物质:①稀盐酸;②浓H2SO4;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H3>△H1>△H2 |
| C.△H1=△H3>△H2 | D.△H2>△H1>△H3 |
下列反应属于吸热反应的是 ( )
| A.中和反应 | B.锌与稀硫酸反应 |
| C.炭燃烧生成CO | D.炭与高温水蒸汽反应 |
.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq) +OH-(aq)═H2O(l)
△H = -57.3kJ/mol。分别向1L 0.5mol/L的Ba(OH)2的溶液中加入①浓硫酸;② 稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
| A.△H1<△H2=△H3 | B.△H1>△H2>△H3 |
| C.△H1>△H2=△H3 | D.△H1=△H2<△H3 |
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)=H2O(l)ΔH1 =-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2 =-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3 =-Q3kJ/mol
若使0.5mol乙醇液体完全燃烧,最后恢复到室温,则放出的热量为(kJ)
| A.Q1+Q2+Q3 |
| B.0.5(Q1+Q2+Q3) |
| C.0.5 Q2-1.5 Q1-0.5Q3 |
| D.1.5 Q1-0.5 Q2+0.5Q3 |
下列关于能量转换的认识中不正确的是
| A.原电池工作时化学能全部转化为电能 |
| B.工业上电解氧化铝制备铝,电能转化成化学能 |
| C.镁在空气中燃烧时化学能不只转变成热能 |
| D.绿色植物光合作用过程中太阳能转变成化学能 |
下列关于化学反应与能量的说法正确的是( )
| A.化学反应中一定有物质变化但不一定有能量变化 |
B.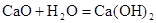 是放热反应,说明CaO的能量大于 是放热反应,说明CaO的能量大于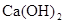 的能量 的能量 |
C.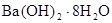 晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应 晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应 |
| D.由H2→2H的过程需要吸收能量 |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol |
| B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.Ba(OH)2·8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
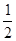 O2(g)═CO(g) ; △H2
O2(g)═CO(g) ; △H2