题目内容
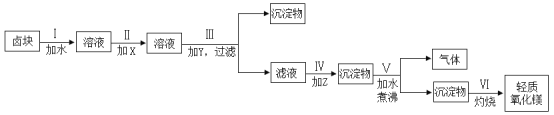
【题目】卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
已知1:生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
已知2:几种难溶电解质的溶解度(20℃)
物质 | 溶解度/g |
Fe(OH)2 | 5.2×10-5 |
Fe(OH)3 | 3×10-9 |
MgCO3 | 3.9×10-2 |
Mg(OH)2 | 9×10-4 |
(已知:Fe2+氢氧化物呈絮状,不易从溶液中除去)
请回答:
(1)步骤Ⅱ中加入的试剂X为漂液(含25.2%NaClO)。
①用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色。说明漂液具有的性质是________。
②用化学用语表示NaClO溶液使pH试纸变蓝的原因_________。
③步骤Ⅱ中漂液的主要作用是__________。
④若用H2O2代替漂液,发生反应的离子方程式为_________。
(2)步骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为______,目的是_______。
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,发生反应的离子方程式为_______。
(4)结合化学用语,应用化学平衡移动原理解释步骤Ⅴ中反应发生的原因_______。
【答案】碱性、强氧化性(漂白性)ClO-+H2O![]() HClO+OH-将Fe2+氧化为Fe3+2Fe2++H2O2+2H+=2Fe3++2H2O9.8使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去Mg2++CO32-=MgCO3↓沉淀物MgCO3存在溶解平衡,MgCO3(s)
HClO+OH-将Fe2+氧化为Fe3+2Fe2++H2O2+2H+=2Fe3++2H2O9.8使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去Mg2++CO32-=MgCO3↓沉淀物MgCO3存在溶解平衡,MgCO3(s)![]() Mg2+ (aq)+CO32-(aq),CO32-发生水解CO32-+H2O
Mg2+ (aq)+CO32-(aq),CO32-发生水解CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-,在煮沸的情况下促进CO32-水解平衡右移。Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3并分解为CO2和H2O。最后使MgCO3转化为Mg(OH)2。或:MgCO3 +H2O
H2CO3+OH-,在煮沸的情况下促进CO32-水解平衡右移。Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3并分解为CO2和H2O。最后使MgCO3转化为Mg(OH)2。或:MgCO3 +H2O![]() Mg(OH)2 +CO2,由于水解生成的Mg(OH)2溶解度更小,煮沸有利于CO32-水解平衡右移,且又有CO2气体生成,使水解趋于完全,MgCO3转化为Mg(OH)2。
Mg(OH)2 +CO2,由于水解生成的Mg(OH)2溶解度更小,煮沸有利于CO32-水解平衡右移,且又有CO2气体生成,使水解趋于完全,MgCO3转化为Mg(OH)2。
【解析】
为除去Fe2+,先将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,然后在滤液中加入纯碱将Mg2+从溶液中以MgCO3沉淀出来,然后加热煮沸可得到Mg(OH)2,灼烧后得到MgO,据此解答。
(1)①漂液(含25.2%NaClO)中NaClO溶液中水解显碱性,pH变蓝色,蓝色褪去是水解生成的次氯酸具有漂白性,用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色,说明漂液具有的性质是碱性、漂白性;
②NaClO溶液使pH试纸变蓝是次氯酸根离子水解生成次氯酸和氢氧根离子,溶液显碱性,反应的离子方程式为ClO-+H2O![]() HClO+OH-;
HClO+OH-;
③步骤Ⅱ中漂液具有强氧化性,氧化亚铁离子为铁离子;
④过氧化氢具有氧化性,酸性溶液中能氧化亚铁离子为铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为9.8,使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀以便通过过滤而除去;
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,加入后沉淀镁离子,发生反应的离子方程式为Mg2++CO32-=MgCO3↓;
(4)由于沉淀物MgCO3存在溶解平衡:MgCO3(s)![]() Mg2+ (aq)+CO32-(aq),CO32-发生水解CO32-+H2O
Mg2+ (aq)+CO32-(aq),CO32-发生水解CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-,在煮沸的情况下促进CO32-水解平衡右移。Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3并分解为CO2和H2O,所以最后使MgCO3转化为Mg(OH)2。
H2CO3+OH-,在煮沸的情况下促进CO32-水解平衡右移。Mg2+与OH-结合生成更难溶的Mg(OH)2沉淀,促进CO32-彻底水解为H2CO3并分解为CO2和H2O,所以最后使MgCO3转化为Mg(OH)2。

 阅读快车系列答案
阅读快车系列答案