题目内容
【题目】亚氯酸钠(NaClO2)是一种高效漂白剂,某小组利用下列装置制备NaClO2,并对其样品进行分析,查阅资料知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时析出NaClO2会分解。
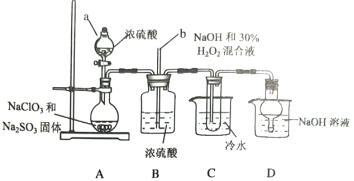
(1)仪器a的名称是__________;长玻璃导管b的作用是__________;装置D的作用是__________。
(2)装置A用于制备ClO2,理论上所加NaClO3和Na2SO3固体的物质的量之比是__________。
装置C中发生的离子方程式是__________。
(3)为提取NaClO2固体,试管中产品需蒸发结晶、过滤、洗涤,洗涤用水的温度范围是__________。
(4)称取Wg的产品配成250mL溶液,取25.00mL溶液,加足量KI和稀H2SO4,以①__________溶液作指示剂,用cmol·L-1Na2S2O3标准液滴定至终点(I2+2S2O32-=2I-+S4O62-),判断滴定终点的现象是②_________;若消耗标准溶液体积的平均值是VmL,则产品中NaClO2的质量分数是③__________%。
【答案】分液漏斗 平衡压强(或平缓气流) 吸收尾气 2∶1 2ClO2+2H2O2+ 2OH-=2ClO2-+2H2O +O2↑ 高于38℃,低于60℃ 淀粉 当滴入最后一滴Na2S2O3溶液,溶液颜色由蓝色变为无色,且半分钟不恢复 ![]()
【解析】
根据装置图可知,装置A中用浓硫酸、NaClO3、Na2SO3混合反应生成ClO2气体,装置B作安全瓶,可防止倒吸,装置C中用ClO2与NaOH溶液和H2O2一起反应生成NaClO2,由于高于60℃时析出NaClO2分解,所以要用冷水浴进行冷却,装置D 用氢氧化钠吸收实验中的尾气,同时可以防止倒吸。
(1)根据装置图可知仪器a的名称是分液漏斗,长玻璃导管b可以平衡压强,装置D可以吸收尾气,防止污染,故答案为:分液漏斗;平衡压强;吸收尾气;
(2)装置A用于制备ClO2,根据化合价升降守恒,理论上所加NaClO3和Na2SO3固体的物质的量之比是2:1;在NaOH溶液中,ClO2被H2O2还原成NaClO2,H2O2被氧化成O2,反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2 ,故答案为:2:1;2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2;
(3)由于NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,要得到NaClO2晶体,在55℃蒸发结晶、趁热过滤后用高于38℃低于60℃的热水洗涤,再低于60℃干燥即可,故答案为:用高于38℃低于60℃的热水洗涤;
(4)根据题意,NaClO2在酸性条件下将碘离子氧化成碘单质,可以选用淀粉作为指示剂,当滴入最后一滴Na2S2O3溶液,溶液颜色由蓝色变为无色,且半分钟不恢复,说明达到了滴定终点;根据电子得失守恒有关系式NaClO2~2I2,再用Na2S2O3滴定生成 的碘,根据反应2S2O32-+I3-═S4O62-+3I-,可得关系式为NaClO2~2I2~4S2O32-,Na2S2O3的物质的量为cV×10-3 mol,则NaClO2的物质的量为![]() ×cV×10-3 mol,所以NaClO2的质量分数为
×cV×10-3 mol,所以NaClO2的质量分数为![]() ×100%=
×100%=![]() %,故答案为:淀粉;当滴入最后一滴Na2S2O3溶液,溶液颜色由蓝色变为无色,且半分钟不恢复;
%,故答案为:淀粉;当滴入最后一滴Na2S2O3溶液,溶液颜色由蓝色变为无色,且半分钟不恢复;![]() %。
%。

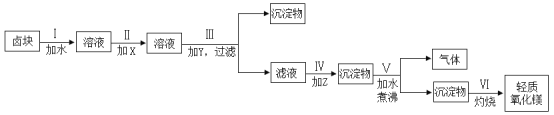
【题目】卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
已知1:生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
已知2:几种难溶电解质的溶解度(20℃)
物质 | 溶解度/g |
Fe(OH)2 | 5.2×10-5 |
Fe(OH)3 | 3×10-9 |
MgCO3 | 3.9×10-2 |
Mg(OH)2 | 9×10-4 |
(已知:Fe2+氢氧化物呈絮状,不易从溶液中除去)
请回答:
(1)步骤Ⅱ中加入的试剂X为漂液(含25.2%NaClO)。
①用玻璃棒蘸取漂液滴在pH试纸上,pH试纸先变蓝,后褪色。说明漂液具有的性质是________。
②用化学用语表示NaClO溶液使pH试纸变蓝的原因_________。
③步骤Ⅱ中漂液的主要作用是__________。
④若用H2O2代替漂液,发生反应的离子方程式为_________。
(2)步骤Ⅲ中加入的试剂Y为NaOH,应将溶液的pH调节为______,目的是_______。
(3)步骤Ⅳ中加入的试剂Z为Na2CO3,发生反应的离子方程式为_______。
(4)结合化学用语,应用化学平衡移动原理解释步骤Ⅴ中反应发生的原因_______。