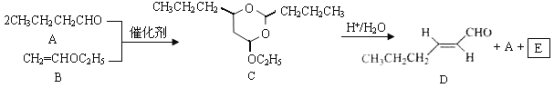
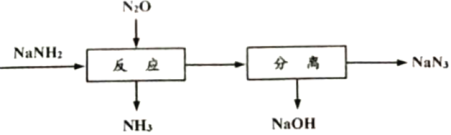
题目内容
【题目】[化学—选修3:物质结构与性质]
硼、碳、镓、砷、硒的化合物被广泛应用于新材料制备、生活生产等诸多领域。根据物质结构相关知识,回答下列问题:
(1)第四周期镓、砷、硒三种元素中,第一电离能由大到小顺序为___________,电负性由大到小顺序为___________(用元素符号填写)
(2)元素氮与砷同族。基态氮元素的价电子排布式为______,预测砷的氢化物分子的立体结构为_____,其沸点比NH3的_____(填“高”或“低”),其判断理由是_________。
(3)硼及化合物应用广泛。
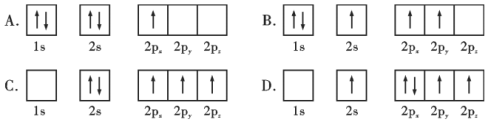
①下列硼原子电子排布图表示的状态中,能量最低和最高的分别为___________、___________(填标号)
②晶体硼单质能自发呈现出正二十面体的多面体外形,这种性质称为晶体的___________。
③已知BP的熔点很高,其晶胞结构如下图所示。
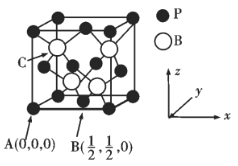
C点的原子坐标为___________,B原子与P原子的最近距离为dpm,晶体的密度为pg/cm3,NA代表阿伏加德罗常数的值,则ρ=___________g/cm3(用含d、NA的代数式表示)
【答案】As>Se>Ga Se>As>Ga 2s22p3 三角锥形 低 NH3分子间存在氢键 A D 自范性 ![]()
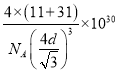
【解析】
(1)As的4p能级含有3个电子,为半满稳定状态,第一电离能较相邻元素高;非金属性越强,电负性越大;
(2)氮元素于元素周期表第二周期VA族;AsH3分子中As原子的价层电子对数为4,孤对电子数为1;NH3分子间可以形成氢键;
(3)①电子处于激发态时能量较高;
②在适宜的条件下,晶体能够自发地呈现封闭的、规则的多面体外形,这称为晶体的自范性;
③由晶胞结构示意图可知B原子位于体对角线的![]() 处;依据分摊法计算晶胞的密度。
处;依据分摊法计算晶胞的密度。
(1)同周期元素从左到右,元素第一电离能逐渐增大,但As的4p能级含有3个电子,为半满稳定状态,第一电离能较相邻元素高,则第一电离能的大小顺序为As>Se>Ga;同周期元素从左到右,非金属性依次增强,电负性依次增大,则电负性的大小顺序为Se>As>Ga,故答案为:As>Se>Ga;Se>As>Ga;
(2)氮元素于元素周期表第二周期VA族,价电子排布式为2s22p3;砷的氢化物为AsH3,分子中As原子的价层电子对数为4,孤对电子数为1,则As原子为sp3杂化,AsH3的立体结构为三角锥形;NH3分子间可以形成氢键,增大了分子间作用力,熔沸点增大,则NH3的沸点高于AsH3,故答案为:2s22p3;三角锥形;低;NH3分子间存在氢键;
(3)①电子处于激发态时能量较高,由图可知,A为B原子的电子排布图,符合能量最低原理,能量最低;B中B原子2s轨道上有1个电子跃迁到2p轨道,有1个电子处于激发态,C中1s轨道上有2个电子跃迁到2p轨道,有2个电子处于激发态,D中1s轨道上有2个电子,2s轨道上有1个电子跃迁到2p轨道,有3个电子处于激发态,则D能量最高,故答案为:A;D;
②在适宜的条件下,晶体能够自发地呈现封闭的、规则的多面体外形,这称为晶体的自范性,则晶体硼单质能自发呈现出正二十面体的多面体外形为晶体的自范性,故答案为:自范性;
③由晶胞结构示意图可知P位于顶点(0,0,0)和面心(![]() ,
,![]() ,0),B原子位于体对角线的
,0),B原子位于体对角线的![]() 处,则C点B原子坐标为(
处,则C点B原子坐标为(![]() ,
,![]() ,
,![]() );晶胞中P原子的数目为(8×
);晶胞中P原子的数目为(8×![]() +6×
+6×![]() )=4,B原子数目为4,晶胞的质量为
)=4,B原子数目为4,晶胞的质量为![]() g,B原子与P原子的最近距离为d×10—10cm,则体对角线的长度为4d×10—10cm,晶胞的变成为
g,B原子与P原子的最近距离为d×10—10cm,则体对角线的长度为4d×10—10cm,晶胞的变成为![]() d×10—10cm,由(
d×10—10cm,由(![]() d×10—10cm)3ρ=
d×10—10cm)3ρ=![]() 可得ρ=
可得ρ=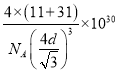 g/cm3,故答案为:(
g/cm3,故答案为:(![]() ,
,![]() ,
,![]() );
);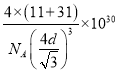 。
。

 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化