题目内容
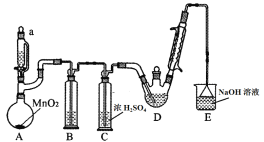
【题目】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
①制备反应原理: C2H5OH + 4Cl2→CCl3CHO+5HCl
可能发生的副反应:
C2H5OH + HCl→C2H5Cl+H2O
CCl3CHO + HClO→CCl3COOH (三氯乙酸) +HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
熔点/℃ | -1 14.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(1)装置B中盛放的试剂是___________;装置E的作用是_______;
(2)若撤去装置C,可能导致装置D中副产物________(填化学式)的量增加;装置D可采用________加热的方法以控制反应温度在70℃左右。
(3)反应结束后,可采用_________的方法从D中的混合物分离出CCl3COOH,除酒精灯、接液管、温度计、锥形瓶外,所需玻璃仪器有_________。
(4)测定产品纯度:称取产品0.30 g配成待测溶液,加入0.1000 mol/L碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.0200 mol/LNa2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00 mL。则产品的纯度为____。(保留3位有效数字)
滴定的反应原理:CCl3CHO +OH—→CHCl3 + HCOO- HCOO-+ I2 → H+ + 2I-+ CO2↑ I2 + 2S2O32-→2I- + S4O62-
(5)请设计实验方案证明三氯乙酸的酸性比乙酸强:________
【答案】饱和食盐水 吸收多余氯气和氯化氢 Cl3CCOOH、C2H5Cl 水浴 蒸馏 蒸馏烧瓶、冷凝管 88.5% 分别测定0.1 mol/L两种酸溶液的pH,三氯乙酸的pH较小
【解析】
A装置利用二氧化锰与浓盐酸制备氯气,B装置用饱和食盐水除去HCl,C装置盛放浓硫酸干燥氯气,D中反应制备CCl3CHO,E装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气,据此分析解答。
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O, B装置用饱和食盐水除去氯气中的氯化氢,氯气有毒,所以E装置中的氢氧化钠溶液目的是除去多余的氯气及反应生成氯化氢,故答案为:饱和食盐水;吸收多余氯气和氯化氢;
(2)氯气能与水反应生成HCl与HClO,会发生:C2H5OH+HCl→C2H5Cl+H2O,CCl3CHO + HClO→CCl3COOH (三氯乙酸)+HCl,导致装置D中副产物:Cl3CCOOH、C2H5Cl增多,控制反应温度在70℃左右,应采取水浴加热,受热均匀,便于控制温度,故答案为:Cl3CCOOH、C2H5Cl;水浴;
(3)根据题给信息知CCl3COOH溶于乙醇与水,沸点较高,应采取蒸馏方法进行分离,蒸馏实验还需要的仪器有蒸馏烧瓶和冷凝管,故答案为:蒸馏;蒸馏烧瓶、冷凝管;
(4)根据消耗的Na2S2O3计算,剩余I2的物质的量0.02000mol·L-1×0.02L=2×10-4mol,与HCOO-反应的I2的物质的量为0.1000mol·L-1×0.02L-2×10-4mol=1.8×10-3mol,由滴定原理分析知: CCl3CHO~ HCOO-~I2可知,CCl3CHO的物质的量为1.8×10-3mol,则产品的纯度为![]() =88.5%,故答案为:88.5%;
=88.5%,故答案为:88.5%;
(5)分别测定0.1mol·L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸电离程度比乙酸的大,则三氯乙酸的酸性比乙酸的强;故答案为:分别测定0.1 mol/L两种酸溶液的pH,三氯乙酸的pH较小。

 阅读快车系列答案
阅读快车系列答案【题目】某学生对SO2与漂粉精的反应进行实验探究,下列叙述错误的是
操作 | 现象 |
①取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
②过滤,测漂粉精溶液的pH | pH试纸先变蓝,最后褪色 |
| 液面上方出现白雾;稍后,出现浑浊,溶液变为黄绿色;最终,产生大量白色沉淀,黄绿色褪去。 |
A.Cl2和Ca(OH)2制取漂粉精的化学方程式是:2Cl2+2Ca(OH)2 →CaCl2+Ca(ClO)2+2H2O
B.pH试纸颜色的变化说明漂粉精溶液具有碱性、漂白性
C.液面上方出现白雾,白雾中一定只含HCl
D.最后,产生大量白色沉淀,黄绿色褪去,推测白色沉淀主要是CaSO4
【题目】铁及其化合物在生产、生活中有广泛应用,如高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂;又知高炉炼铁过程中发生的主要反应为:
![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g)+ Q kJ,下表中是该反应在不同温度下的平衡常数 :
Fe(s)+CO2(g)+ Q kJ,下表中是该反应在不同温度下的平衡常数 :
温度/℃ | 1000 | 1115 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=______;Q______0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正___υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=______;
(3)已知:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有____________、____________;
4Fe(OH)3+8OH-+3O2。 K2FeO4在处理水的过程中所起的作用有____________、____________;
(4)高铁酸钾水溶液中FeO42-的存在形态及它们的物质的量分数随pH的变化如下图所示:
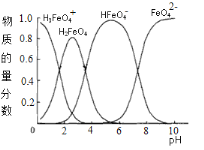
(i)pH=2时溶液存在如下等量关系: c(K+)=_____________;
(ii)向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为_________。