题目内容
4.设NA为阿伏加德罗常数,下列叙述正确的是( )| A. | 18gD2O(重水)含有的质子数、电子数和中子数均为10NA | |
| B. | 2molSO2和1molO2通入密闭容器中,发生反应2SO2(g)+O2(g)$\frac{\underline{\;催化剂\;}}{△}$2SO3(g),反应完成时,生成SO3分子数小于2NA | |
| C. | 7.8gNa2O2固体含有的离子数为0.4NA | |
| D. | 2.24LH2完全燃烧时,断裂H-H键数目为0.1NA |
分析 A、重水的摩尔质量为20g/mol;
B、反应2SO2(g)+O2(g)$\frac{\underline{\;催化剂\;}}{△}$2SO3(g)为可逆反应,不能进行彻底;
C、Na2O2由2个Na+和1个O22-构成;
D、氢气所处的状态不明确.
解答 解:A、每个D2O分子中含有10个电子和10个质子,但重水的摩尔质量为20g/mol,故18gD2O的物质的量小于1mol,所以18gD2O含有的电子数小于10NA,故A错误;
B、反应2SO2(g)+O2(g)$\frac{\underline{\;催化剂\;}}{△}$2SO3(g)为可逆反应,不能进行彻底,故2molSO2和1molO2通入密闭容器中,反应完成时,生成SO3分子数小于2NA,故B正确;
C、7.8gNa2O2的物质的量n=$\frac{m}{M}$=$\frac{7.8g}{78g/mol}$=0.1mol,而Na2O2由2个Na+和1个O22-构成,故0.1molNa2O2中含0.3mol离子,即0.3NA个,故C错误;
D、氢气所处的状态不明确,不一定是标况,故22.4L氢气的物质的量不能计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
7.在一固定体积的密闭容器中,进行下列反应:CO2(g)+H2(g)?CO(g)+H2O(g)△H=a kJ•mol-1
其化学平衡常数K和温度T的关系如下表所示:
则下列有关叙述正确的是( )
其化学平衡常数K和温度T的关系如下表所示:
| T(℃) | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| A. | a>0 | |
| B. | 可测量容器总压变化来判定化学反应是否达到平衡 | |
| C. | 温度为830℃时,若c(CO2)•c(H2)>c(CO)•c(H2O),此时还未达平衡 | |
| D. | 温度不变,增大c(CO2),平衡右移,K增大 |
15.某校化学小组设计如图的装置制备氯气并探究氯气的某些化学性质:
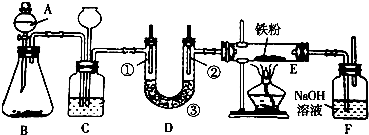
(1)欲利用浓盐酸与B不加热制取氯气,则B可选用下列物质中的bc;
a.MnO2 b.Ca(ClO)2 c.KMnO4 d.NaCl
(2)C装置的作用是安全瓶;C中加入饱和食盐水 溶液;当C后面的装置发生堵塞时,C中的现象是:长颈漏斗中液面上升.
(3)装置D用于验证氯气的漂白性,①是湿润的有色布条 ③是无水氯化钙或五氧化二磷
(4)为探究氯气与Fe反应的产物与氯气通入量的关系,设计实验,并记录现象如下:
根据实验结论,氯气与Fe粉共热时发生反应的化学方程式:2Fe+3Cl2=2FeCl3.

(1)欲利用浓盐酸与B不加热制取氯气,则B可选用下列物质中的bc;
a.MnO2 b.Ca(ClO)2 c.KMnO4 d.NaCl
(2)C装置的作用是安全瓶;C中加入饱和食盐水 溶液;当C后面的装置发生堵塞时,C中的现象是:长颈漏斗中液面上升.
(3)装置D用于验证氯气的漂白性,①是湿润的有色布条 ③是无水氯化钙或五氧化二磷
(4)为探究氯气与Fe反应的产物与氯气通入量的关系,设计实验,并记录现象如下:
| 实验方法 | 实验现象 | 实验结论 |
| 1.取反应初始阶段(氯气不足量)E中产物,用磁铁除去过量的Fe,剩余产物溶于水中,取上层溶液,①加入KSCN溶液,②加入KMnO4溶液 | ① ② | 生成物中没有FeCl2 生成物中含有FeCl3 |
| 2.取充分反应后(氯气通入足够长时间)E中产物,溶于水中,加入KMnO4溶液 | KSCN溶液显红色, KMnO4溶液不褪色 |
12.绿色化学的核心就是利用化学原理从源头上减少和 消除工业生产对环境的污染.下列转化符合绿色化学原则,且原子利用率为100%的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH2Cl+HCl | B. | 2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | ||
| C. | CH2=CH2+Br2$\stackrel{一定条件}{→}$CH2BrCH2Br | D. | 3NO2+H2O═2HNO3+NO |
19.关于吸热反应、放热反应的叙述正确的是( )
| A. | Ba(OH)2+H2SO4═BaSO4↓+2H2O既是放热反应又是氧化还原反应 | |
| B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O反应物的总能量低于生成物的总能量 | |
| C. | C(石墨)$\frac{一定条件}{\;}$C(金刚石)是吸热反应,所以金刚石比石墨更稳定 | |
| D. | 吸热反应和放热反应都遵守能量守恒定律 |
9.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见右表.回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.已知:3Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-.则溶液中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见右表.回答下列问题:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.已知:3Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-.则溶液中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).
16.下列变化过程中肯定要放出热量的是( )
| A. | H2→H+H | B. | H+Cl→HCl | ||
| C. | C(石墨)→C(金刚石) | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2 |
14.利用下列实验装置进行的相应实验,能达到实验目的是(部分夹持仪器未画出)( )
| A. | 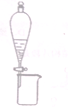 分离乙醇和乙酸乙酯 | |
| B. | 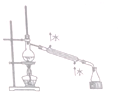 分离苯和甲苯 | |
| C. | 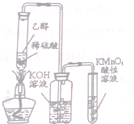 实验室制备,收集乙烯并验证其易被氧化 | |
| D. |  实验室制取乙酸乙酯 |
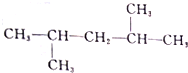 ⑪
⑪ ⑫
⑫