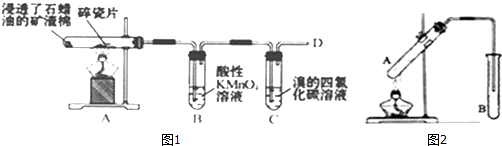
题目内容
8.实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如图1所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题: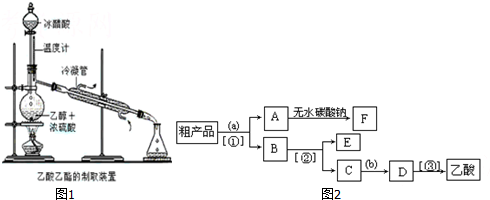
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是防止液体暴沸.
(2)配制乙醇和浓硫酸的混合液的方法是:先在烧瓶中加入一定量的乙醇,然后慢慢将浓硫酸加入烧瓶,边加边振荡.
(3)在该实验中,若用1mol乙醇和1mol 乙酸在浓硫作用下加热,充分反应,不能生成1mol乙酸乙酯的主要原因是该反应是可逆反应,反应不能进行到底;乙醇、乙酸受热挥发原料损失.
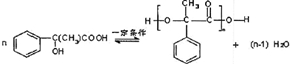
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,图2是分离操作步骤流程图.请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法.
试剂:a是饱和的碳酸钠溶液,试剂:b是硫酸.
分离方法:①是分液,②是蒸馏,③是蒸馏.
分析 (1)加入碎瓷片可防止液体暴沸;
(2)从防止酸液飞溅的角度分析;
(3)反应为可逆反应,不能完全进行;
(4)粗产品乙酸乙酯中含有乙酸与乙醇,用饱和的碳酸钠溶液反应掉乙酸,溶解乙醇,同时降低乙酸乙酯的溶解度,便于溶液分层,乙酸乙酯密度比水小,乙酸乙酯在上层,然后利用分液,乙酸乙酯加入无水碳酸钠吸收其中的水,可得乙酸乙酯;溶液中含有乙醇、碳酸钠、乙酸钠,进行蒸馏可以收集乙醇,向蒸出乙醇的溶液中加入硫酸,可以得到乙酸,再进行蒸馏可以收集乙酸.
解答 解:(1)加入碎瓷片可防止液体暴沸,故答案为:防止液体暴沸;
(2)浓硫酸溶于水放出大量的热,且密度比水大,为防止酸液飞溅,应先在烧瓶中加入一定量的乙醇,然后慢慢将浓硫酸加入烧瓶,边加边振荡,
故答案为:乙醇;浓硫酸;
(3)乙酸和乙醇制备乙酸乙酯的反应为可逆反应,反应不能进行到底;乙醇、乙酸受热挥发原料损失,
故答案为:该反应是可逆反应,反应不能进行到底;乙醇、乙酸受热挥发原料损失;
(4)粗产品乙酸乙酯中含有乙酸与乙醇,用饱和的碳酸钠溶液反应掉乙酸,溶解乙醇,同时降低乙酸乙酯的溶解度,便于溶液分层,乙酸乙酯密度比水小,乙酸乙酯在上层,然后利用分液,乙酸乙酯加入无水碳酸钠吸收其中的水,可得乙酸乙酯;溶液中含有乙醇、碳酸钠、乙酸钠,进行蒸馏可以收集乙醇,向蒸出乙醇的溶液中加入硫酸,可以得到乙酸,再进行蒸馏可以收集乙酸;
故答案为:饱和的碳酸钠溶液;硫酸;分液,蒸馏,蒸馏.
点评 本题考查乙酸乙酯的制备,难度不大,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,(4)中试剂b选择,由于盐酸易挥发,不能使用盐酸.

练习册系列答案
相关题目
16.下列各组物质各自形成晶体,均属于分子晶体的化合物是( )
| A. | NH3、HD、C3H8 | B. | PCl3、CO2、H2SO4 | C. | SO2、BN、P2O5 | D. | CCl4、Na2S、H2O2 |
3.草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应:2KMnO4+5H2C2O4+3H2SO4═2MnSO4+10CO2↑+K2SO4+8H2O用一定量的混合溶液(其中KMnO4为4.0mL 0.2mol•L-1、H2C2O4为2.0mL 0.5mol•L-1)来探究不同条件对化学反应速率的影响.改变的条件如下:
(1)如果研究催化剂对化学反应速率的影响,使用实验①和②(用①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验①和③.
(2)经过5分钟反应,实验①中草酸完全消耗,则草酸的平均反应速率为0.025mol/(L•min).
(3)反应生成的CO2可以用来合成甲醇(CH3OH):CO2(g)+3H2(g)═CH3OH(g)+H2O(g),
该反应是放热反应.断裂1mol CO2中的化学键消耗能量Q1kJ,断裂1mol H2中的化学键消耗能量Q2kJ,形成1mol CH3OH中的化学键释放能量Q3kJ,形成1mol H2O中的化学键释放能量Q4kJ,则该条件下,生成1mol CH3OH放出的能量为(3Q3+Q4-3Q2-Q1)kJ (用Q1、Q2、Q3、Q4的计算式表示).
(4)在一定条件下,密闭容器中进行的反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
达到化学平衡状态,下列说法正确的是B(填序号).
A.各物质的浓度相等
B.消耗3mol H2的同时消耗1mol CH3OH
C.反应达到平衡时,升高温度反应速率不变.
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| ① | 2 | 20 | |
| ② | 2 | 20 | 10滴饱和MnSO4溶液 |
| ③ | 2 | 30 | |
| ④ | 1 | 30 | 1mL蒸馏水 |
(2)经过5分钟反应,实验①中草酸完全消耗,则草酸的平均反应速率为0.025mol/(L•min).
(3)反应生成的CO2可以用来合成甲醇(CH3OH):CO2(g)+3H2(g)═CH3OH(g)+H2O(g),
该反应是放热反应.断裂1mol CO2中的化学键消耗能量Q1kJ,断裂1mol H2中的化学键消耗能量Q2kJ,形成1mol CH3OH中的化学键释放能量Q3kJ,形成1mol H2O中的化学键释放能量Q4kJ,则该条件下,生成1mol CH3OH放出的能量为(3Q3+Q4-3Q2-Q1)kJ (用Q1、Q2、Q3、Q4的计算式表示).
(4)在一定条件下,密闭容器中进行的反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
达到化学平衡状态,下列说法正确的是B(填序号).
A.各物质的浓度相等
B.消耗3mol H2的同时消耗1mol CH3OH
C.反应达到平衡时,升高温度反应速率不变.
13.类推的思维方法在化学学习与研究中常会产生错误的结论.因此,类推出的结论最终要经过实践的检验才能决定其正确与否.以下几种类推结论中,正确的是( )
| A. | Fe3O4可以写成FeO•Fe2O3,Pb3O4也可以写成PbO•Pb2O3 | |
| B. | 不能用电解AlCl3溶液来制取金属铝,也不能用电解MgCl2溶液来制取金属镁 | |
| C. | Fe和S直接化合不能得到Fe2S3,Al和S直接化合也不能得到Al2S3 | |
| D. | FeS可以和稀硫酸反应制取硫化氢气体,CuS也可以和稀硫酸反应制取硫化氢气体 |
17.下列除去括号内杂质的有关操作正确的是( )
| A. | 苯(苯酚):加浓溴水振荡,分液 | |
| B. | 硝酸(硝酸镁):加热,蒸馏 | |
| C. | 肥皂液(甘油):加食盐颗粒,过滤 | |
| D. | 乙酸乙酯(乙酸):加氢氧化钠溶液,分液 |
18.下列反应中的能量变化与图相符的是( )


| A. | 煤的气化 | B. | 乙醇燃烧 | C. | 中和反应 | D. | 铝热法炼铁 |
 (包括顺反异构)
(包括顺反异构)
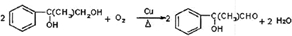
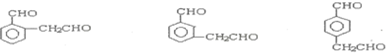 .
.