题目内容
12.2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O反应中,若消耗1mol氧化剂,则被氧化的还原剂的物质的量是5mol.分析 2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O反应中,Br元素化合价升高,Mn元素化合价降低,则反应中KMnO4为氧化剂,HBr为还原剂,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,据此分析.
解答 解:反应KMnO4+HBr→Br2+MnBr2+KBr+H2O中,Br元素化合价升高,Mn元素化合价降低,
则反应中KMnO4为氧化剂,HBr为还原剂,
Mn元素化合价由+7→+2价,变化5价,Br元素化合价由-1价→0价,变化1价,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,设被氧化的还原剂的物质的量是x,
则有1mol×(7-2)=x×(1-0),
x=5mol,
故答案为:5.
点评 本题考查氧化还原反应,题目难度不大,注意从化合价的角度分析,计算时注意氧化还原反应中氧化剂和还原剂之间得失电子数目相等,表现为化合价升降总数相等.

练习册系列答案
相关题目
2.电解法炼铝时,冰晶石的作用是( )
| A. | 助熔剂 | B. | 催化剂 | C. | 还原剂 | D. | 氧化剂 |
20.下列离子方程式不正确的是( )
| A. | 用碳酸钠溶液吸收少量二氧化硫:2 CO32-+SO2+H2O=2 HCO3-+SO32- | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液使SO42-沉淀完全:2Ba2++NH4++Al3++2 SO42-+4OH-=Al(OH)3↓+2BaSO4↓+NH3•H2O | |
| C. | 0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-=SO42-+Cl-+H+ | |
| D. | 将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合:6 AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
7.最近,美国科学家宣布其发现的二种超重新元素是错误的;俄罗斯科学家则宣布发现了114号超重新元素,其相对原子质量为289,质子数为114.下列说法正确的是( )
| A. | 114号元素原子的中子数为175 | |
| B. | 114号元素原子的中子数为403 | |
| C. | 科学家宣布自己的研究成果错误是可耻的 | |
| D. | 科学研究成果是不可能有错误的 |
17.下列物质分子的几何构型为正四面体的是( )
| A. | CH4 | B. | NH3 | C. | H2O | D. | CO2 |
4.短周期元素的原子,处于基态时可能具有的电子是( )
| A. | 只有s和p电子 | B. | 只有s电子 | C. | 只有p电子 | D. | 有s、p和d电子 |
2.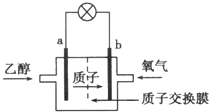 在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
 在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )
在2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇(CH3OH)电池效率高出32倍,且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图所示,下列说法中正确的是( )| A. | a极为电池的正极 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:4H++O2+4e-=2H2O | |
| D. | 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移 |