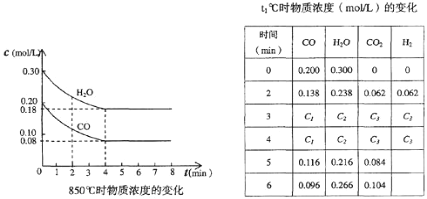
题目内容
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
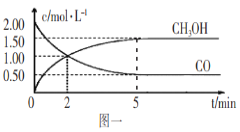
①从反应开始到l0min,用一氧化碳表示的平均反应速率v(CO)=____________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=__________kJ/mol;
CaCO3(s)+2H2(g)的△H=__________kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
(3)甲醇作为一种燃料还可用于燃料电池。在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。该电池的负极反应式为_________。
【答案】
(1)①0.3mol/(L·min);(无单位不给分) ②B
(2) ①-90.3 K1·K2·K3②A
(3)CH3OH - 6e-+3CO32-= 4CO2↑+2H2O
【解析】
试题分析:(1)①反应开始到5min,反应达到平衡,平衡后反应速率不变,用一氧化碳表示的平均反应速率v(CO)= ![]() =
=![]() =0.3mol/(L·min) ,故答案为:0.3mol/(L·min);
=0.3mol/(L·min) ,故答案为:0.3mol/(L·min);
②A.达到平衡时,CO的转化率=![]() ×100%=75%,根据方程式和起始充入的量的关系,因此H2的转化率为75%,错误;B.5min后容器中反应达到平衡,混合气体的平均相对分子质量不再改变,正确;C.达到平衡后,再充入氩气,容器的体积不变,物质的浓度不变,反应速率不变,错误;D.5min后容器中反应达到平衡,因此2min前v(正)>v(逆),2min后v(正)>v(逆),错误;故选B;
×100%=75%,根据方程式和起始充入的量的关系,因此H2的转化率为75%,错误;B.5min后容器中反应达到平衡,混合气体的平均相对分子质量不再改变,正确;C.达到平衡后,再充入氩气,容器的体积不变,物质的浓度不变,反应速率不变,错误;D.5min后容器中反应达到平衡,因此2min前v(正)>v(逆),2min后v(正)>v(逆),错误;故选B;
(2)①Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol,Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol,Ⅲ:CaO(s)+CO2(g)=CaCO3(s) △H= - 178.3kJ/mol,根据盖斯定律,将Ⅰ+Ⅱ+Ⅲ得,C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g) △H=(+131.0kJ/mol)+(- 43kJ/mol)+(- 178.3kJ/mol)=-90.3 kJ/mol;根据上述分析,该平衡常数K= K1·K2·K3,故答案为:-90.3;K1·K2·K3;
CaCO3(s)+2H2(g) △H=(+131.0kJ/mol)+(- 43kJ/mol)+(- 178.3kJ/mol)=-90.3 kJ/mol;根据上述分析,该平衡常数K= K1·K2·K3,故答案为:-90.3;K1·K2·K3;
②反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)△H=-90.3 kJ/mol。A.降低体系的温度,平衡正向移动,H2产率增大,正确;B.压缩容器的体积,平衡不移动,H2产率不变,错误;C.增加CaO的量,平衡不移动,H2产率不变,错误;D.选用适当的催化剂,平衡不移动,H2产率不变,错误;故选A;
CaCO3(s)+2H2(g)△H=-90.3 kJ/mol。A.降低体系的温度,平衡正向移动,H2产率增大,正确;B.压缩容器的体积,平衡不移动,H2产率不变,错误;C.增加CaO的量,平衡不移动,H2产率不变,错误;D.选用适当的催化剂,平衡不移动,H2产率不变,错误;故选A;
(3) 通入甲醇的为负极,负极发生氧化反应,由于用Li2CO3和Na2CO3混合物作电解质,因此负极结合碳酸根离子生成二氧化碳,负极反应式为CH3OH - 6e-+3CO32-= 4CO2↑+2H2O,故答案为:CH3OH - 6e-+3CO32-= 4CO2↑+2H2O。