题目内容
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
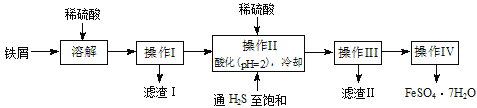
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是__________________________。
(2)操作II中,通入硫化氢至饱和的目的是_________________________________;在溶液中用硫酸酸化至pH=2的目的是___________________________________________。
(3)操作IV的顺序依次为:_________________、冷却结晶、__________________。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②________________________________________________________。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为:___________________。
②判断此滴定实验达到终点的方法是_______________________________________。
③计算上述样品中FeSO4·7H2O的质量分数为_________(用小数表示,保留三位小数)。
【答案】取少量晶体溶于水,滴加KSCN溶液,溶液不呈现红色,表明溶液不含Fe3+ 除去溶液中的Sn2+,并防止Fe2+被氧化 防止Fe2+生成沉淀 蒸发浓缩 过滤、洗涤、干燥 降低洗涤过程中FeSO4·7H2O的损耗 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 滴入最后一滴KMnO4溶液时,溶液变为浅红色且半分钟内不褪色 0.975
【解析】
含少量锡、氧化铁等杂质的铁屑用稀硫酸溶解,得到含Fe2+和Sn2+的溶液,不溶性的杂质过滤除去,滤液里通入H2S,使Sn2+形成SnS沉淀,控制溶液的PH=2,保证Fe2+不沉淀,过滤后把含有FeSO4的滤液蒸发浓缩、冷却结晶,即可过滤得到FeSO4·7H2O。
(1)Fe3+的检验可以用KSCN溶液,即取少量晶体溶于水,滴加KSCN溶液,溶液不呈现红色,表明溶液不含Fe3+。
(2)操作II中,通入硫化氢,使Sn2+形成SnS沉淀,同时由于Fe2+具有还原性,容易被氧化,而H2S可以保护Fe2+不被氧化。由于SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,所以在溶液中用硫酸酸化至pH=2。故答案为:除去溶液中的Sn2+,并防止Fe2+被氧化;防止Fe2+生成沉淀。
(3)从溶液中获得带结晶水的晶体,为了防止加热失去结晶水,所以需要将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩,过滤、洗涤、干燥。
(4)操作IV得到的绿矾晶体上附着有硫酸等杂质,需要洗涤,而绿矾溶于水,但在冰水中溶解度比较小,所以用冰水洗涤,故答案为降低洗涤过程中FeSO4·7H2O的损耗。
(5)①KMnO4和Fe2+发生氧化还原反应,离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 。
②KMnO4溶液是紫红色的,当溶液中的Fe2+耗尽时,再滴入KMnO4溶液,溶液会呈现KMnO4溶液的颜色,此时即达到了滴定终点,故答案为:滴入最后一滴KMnO4溶液时,溶液变为浅红色且半分钟内不褪色。
③n(KMnO4)= 0.01000mol/L×0.02000L=2×10-4mol,根据反应方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,n(Fe2+)=5×2×10-4mol=1×10-3mol,所以25.00mL 溶液中m(FeSO4·7H2O)= 1×10-3mol×278g/mol=0.2780g,则250mL溶液中的FeSO4·7H2O的质量为2.7800g,所以样品中FeSO4·7H2O的质量分数为:![]() =0.975。
=0.975。

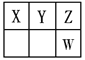
【题目】在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)![]() 2C(g) ΔH<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合下图中曲线的是( )
2C(g) ΔH<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合下图中曲线的是( )
x | y |
| |
A | 温度 | 混合气体的平均相对分子质量 | |
B | 压强 | A的百分含量 | |
C | 再通入A | B的转化率 | |
D | 加入催化剂 | A的质量分数 |
A.AB.BC.CD.D
【题目】一定温度下,在3个体积均为1L的恒容密闭容器中发生反应CO(g)+H2S(g)COS(g)+H2(g)△H=akJmol-1达到平衡。下列说法不正确的是
容器编号 | 温度/K | 物质的起始浓度/molL-1 | 物质的平衡浓度/molL-1 | |||
CO(g) | H2S(g) | COS(g) | H2(g) | COS(g) | ||
1 | T1 | 10.0 | 7.0 | 0 | 0 | 2.0 |
2 | T1 | 5.0 | 3.5 | 0 | 0 | |
3 | T2 | 3.0 | 0 | 7.0 | 7.0 | 1.5 |
A.若T1>T2,则a>0
B.T1K时,该反应的平衡常数K=0.1
C.容器3中反应达到平衡后,再充入1.1molH2S(g)和0.3molH2(g),平衡不移动
D.容器1中H2S的平衡转化率比容器2小