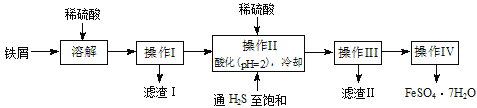
题目内容
【题目】一定温度下,在3个体积均为1L的恒容密闭容器中发生反应CO(g)+H2S(g)COS(g)+H2(g)△H=akJmol-1达到平衡。下列说法不正确的是
容器编号 | 温度/K | 物质的起始浓度/molL-1 | 物质的平衡浓度/molL-1 | |||
CO(g) | H2S(g) | COS(g) | H2(g) | COS(g) | ||
1 | T1 | 10.0 | 7.0 | 0 | 0 | 2.0 |
2 | T1 | 5.0 | 3.5 | 0 | 0 | |
3 | T2 | 3.0 | 0 | 7.0 | 7.0 | 1.5 |
A.若T1>T2,则a>0
B.T1K时,该反应的平衡常数K=0.1
C.容器3中反应达到平衡后,再充入1.1molH2S(g)和0.3molH2(g),平衡不移动
D.容器1中H2S的平衡转化率比容器2小
【答案】D
【解析】
T1时,列“三段式”:
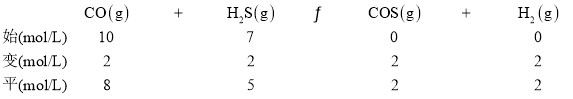 K1=
K1=![]() =0.1,
=0.1,
容器1、2比较,温度相同,1看成2体积减小一半,压强增大,平衡不移动,二者为等效平衡;
T2时,列“三段式”:

K2=![]() =0.048,以此来解答。
=0.048,以此来解答。
A.若T1>T2,由上述分析可知,降低温度K减小,平衡逆向移动,正反应为吸热反应,则a>0,故A正确;
B.由上述计算可知,T1时,该反应的平衡常数K=0.1,故B正确;
C.容器3中反应达到平衡后,再充入1.1molH2S(g)和0.3molH2(g), c(H2S)=6.6mol/L,c(H2)=1.8mol/L,浓度商Qc=![]() =K=0.048,平衡不移动,故C正确;
=K=0.048,平衡不移动,故C正确;
D.容器1、2比较,温度相同,1看成2体积减小一半,压强增大,平衡不移动,二者为等效平衡,转化率相同,故D错误;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 2.00 | 0.00 |
1 | 0.90 | 1.80 | 0.20 |
3 | 0.75 | 1.50 | 0.50 |
5 | 0.65 | 1.30 | 0.70 |
9 | 0.55 | 1.10 | 0.90 |
10 | 0.55 | 1.10 | 0.90 |
14 | 0.55 | 1.10 | 0.90 |
(1)体系中发生反应的化学方程式____________;
(2)列式计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3)该反应达到平衡时反应物X的转化率α等于________;
(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1____________,2______________,3______________。