题目内容
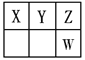
【题目】Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21。
(1)写出W的简单离子的原子结构示意图为_____________;氢元素与Z形成原子个数比为1∶1的化合物,其结构式为__________;
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是(用离子方程式表示)_______________;
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式为___________,反应中每转移8mol 电子,消耗的还原剂质量为_______g;
(4)写出能说明Y的非金属性比Z弱的一个实验事实:_____________;
Ⅱ.往1L体积不变的容器中加入0.200mol CO和1.00mol H2O(g),在t℃时反应:CO+ H2O(g)![]() CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为___________;
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为___________;
Ⅲ.甲醇燃料电池是一种相对理想的绿色能源,可用于电动汽车的电源;若该燃料电池以硫酸为电解质溶液,总反应为:2CH3OH + 3O2= 2CO2+ 4H2O,则其正极的电极反应式______________。
【答案】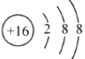 H-O-O-H NH4++H2O
H-O-O-H NH4++H2O![]() NH3·H2O + H+ C + 4HNO3
NH3·H2O + H+ C + 4HNO3![]() CO2↑ +4NO2↑ +2H2O 24 O2比N2更容易与氢气化合(或H2O比NH3更稳定,其它合理答案均可) 83.3% O2+ 4H++4e-=2H2O
CO2↑ +4NO2↑ +2H2O 24 O2比N2更容易与氢气化合(或H2O比NH3更稳定,其它合理答案均可) 83.3% O2+ 4H++4e-=2H2O
【解析】
Ⅰ.根据短周期元素X、Y、Z、W在元素周期表中的位置和X、Y、Z三种元素的质子数之和为21确定四种元素分别为C、N、O、S。
(1)H与O形成原子个数比为1∶1的化合物为H2O2;
(2)Y的最高价氧化物对应的水化物为硝酸,Y的氢化物为氨气,反应产物为硝酸铵,NH4+水解使溶液显酸性;
(3)浓硝酸与碳反应的方程式为C+4HNO3![]() CO2↑+4NO2↑+2H2O,根据化合价变化计算还原剂的质量;
CO2↑+4NO2↑+2H2O,根据化合价变化计算还原剂的质量;
(4)根据和氢气化合的难易程度、氢化物的稳定性以及最高价氧化物的水化物的酸性判断非金属性的强弱;
Ⅱ.根据化学平衡常数K=1,用三段式计算CO 的转化率;
Ⅲ.燃料电池的正极是氧气得到电子,根据电解质溶液为酸性写出正极的电极反应式。
Ⅰ.假设X的质子数为x,因为X、Y、Z三种元素的质子数之和为21,则x+(x+1)+(x+2)=21,解得x=6,则X为C元素、Y为N元素、Z为O元素、W为S元素。
(1)W为S,其离子结构示意图为 ;H元素与Z形成的原子个数比为1:1的化合物为H2O2,其结构式为H-O-O-H,故答案为
;H元素与Z形成的原子个数比为1:1的化合物为H2O2,其结构式为H-O-O-H,故答案为 ;H-O-O-H;
;H-O-O-H;
(2)Y的最高价氧化物对应的水化物为硝酸,Y的氢化物为氨气,反应产物为硝酸铵,其水溶液呈酸性,因为在水溶液中NH4+可以发生水解,离子方程式为NH4++H2O![]() NH3·H2O+H+,故答案为NH4++H2O
NH3·H2O+H+,故答案为NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(3)浓硝酸与碳反应的方程式为C+4HNO3![]() CO2↑+4NO2↑+2H2O,该反应中,C由0价上升至+4价态,N由+5价下降至+4价态,若有8mol电子发生转移,消耗还原剂C为2mol,质量为24g,故答案为C+4HNO3
CO2↑+4NO2↑+2H2O,该反应中,C由0价上升至+4价态,N由+5价下降至+4价态,若有8mol电子发生转移,消耗还原剂C为2mol,质量为24g,故答案为C+4HNO3![]() CO2↑+4NO2↑+2H2O;24;
CO2↑+4NO2↑+2H2O;24;
(4)比较非金属性的方法有很多,比如氧气比氮气更容易与氢气化合,或水比氨气更稳定等,故答案为O2比N2更容易与氢气化合或H2O比NH3更稳定等;
Ⅱ、设反应的CO的物质的量为x,
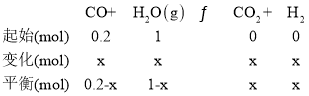
则平衡常数K=
![]() =1,解得:x=
=1,解得:x=![]() mol,则CO的转化率=
mol,则CO的转化率=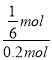 ×100%=83.3%,故答案为83.3%;
×100%=83.3%,故答案为83.3%;
Ⅲ.若该燃料电池以硫酸为电解质溶液,总反应为:2CH3OH + 3O2= 2CO2+ 4H2O,则正极上氧气得到电子发生还原反应,电极反应式为O2+ 4H++4e-=2H2O,故答案为O2+ 4H++4e-=2H2O。