题目内容
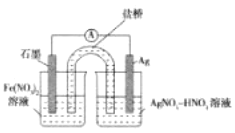
【题目】下图所示装置中,甲池的总反应式为2CH3OH+ 3O2+ 4KOH=2K2CO3+ 6H2O。试回答:
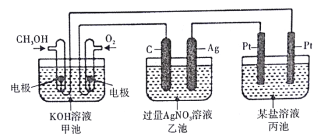
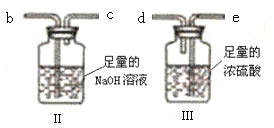
(1)图中甲池的装置是_________(填“原电池”或“电解池”),乙池中石墨电极是________极。
(2)写出通入CH3OH的电极的电极反应式:________________
(3)乙池中总反应的化学方程式为___________________
(4)当乙池中Ag极的质量增加5.40g时,甲池中理论上消耗O2________mL(标准状况);此时丙池某电极上析出1.60g某金属,则丙池中的盐溶液可能是________(填字母)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
【答案】原电池 阳 CH3OH-6e-+8OH-===6H2O+CO32- 4AgNO3+2H2O 4Ag+O2↑+4HNO3 280 BD
4Ag+O2↑+4HNO3 280 BD
【解析】
(1)甲装置为燃料电池;A与原电池的正极相连;
(2)燃料电池中燃料失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水;B电极与原电池负极相连,为阴极,银离子在B上得电子;
(3)乙为电解池,电解质溶液为AgNO3;
(4)乙池是电解池,碳作阳极,银作阴极,所以反应是电解硝酸银溶液;根据转移电子守恒计算消耗氧气 等体积,丙池中,阴极上析出金属,根据转移电子计算金属的相对原子质量,从而确定盐。
(1)甲装置为甲醇燃料电池,属于原电池,A与原电池的正极相连,则A为阳极,故答案为:原电池;阳;
(2)燃料电池中,燃料在负极失电子发生氧化反应,则碱性条件下,燃料甲醇在负极失电子发生氧化反应生成碳酸根离子和水,电极反应式是CH3OH-6e-+8OH-═6H2O+CO32-,故答案为:CH3OH-6e-+8OH-═6H2O+CO32-;
(3)乙为电解池,电解时,AgNO3溶液电解生成硝酸、银和水,反应的化学方程式为4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O
4Ag+O2↑+4HNO3,故答案为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(4)乙池中A(Ag)极上银离子得电子生成Ag,其电极反应为Ag++e-=Ag,已知A(Ag)极的质量增加5.40g时,n(Ag)=0.05mol,则转移电子为0.05mol,甲中正极反应为:O2+4e-+H2O=4OH-,则转移0.05mol电子时消耗的氧气为0.0125mol,则氧气的体积为0.0125mol×22.4L/mol=0.28L=280ml;丙池是电解池,阴极上金属离子放电析出金属单质,则金属元素在氢元素之后,D电极连接甲醇电极,所以D是阴极,根据转移电子相等知,当析出一价金属时,其摩尔质量=1.6÷0.05=32g/mol,该元素为硫,错误,当析出的是二价金属,则其摩尔质量=(1.6÷0.05)×2=64g/mol,所以该金属是铜,则溶液是硫酸铜溶液,也可能是硝酸银放电结束后水放电,所以也可能是硝酸银,故选BD,故答案为:280;BD。

 能考试全能100分系列答案
能考试全能100分系列答案【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 400mL 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL (标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大______min(填“0~1”“1~2”“2~3”“3~4”或“4~5”),原因是______。
②求 3~4 min 时间段以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是______ (填字母)。
A.蒸馏水 B.KCl 溶液 C.KNO3 溶液 D.CuSO4 溶液
(3)某温度下在 4 L 密闭容器中,X、Y、Z 三种气态物质的物质的量随时间变化曲线如图:
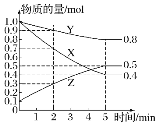
①该反应的化学方程式是______。
②该反应达到平衡状态的标志是_______(填字母)。
A.Y 的体积分数在混合气体中保持不变
B.X、Y 的反应速率比为 3:1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成 1mol Y 的同时消耗 2mol Z
③2 min 内 Y 的转化率为_______。
【题目】向硝酸酸化的2mL0.1molL-1AgNO3溶液(pH=2)中加入过量铁粉,振荡后静置,溶液先呈浅绿色,后逐渐呈粽黄色,试管底部仍存有黑色固体,过程中无气体生成。实验小组同学针对该实验现象进行如下探究。
Ⅰ.探究Fe2+产生的原因
(1)提出猜想:Fe2+可能是Fe与____或___反应的产物。
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液
液体试剂 | 加人铁氰化钾溶液 | |
1号试管 | 2mL.0.1molL-1AgNO3溶液 | 无蓝色沉淀 |
2号试管 | ______ | 蓝色沉淀 |
①2号试管中所用的试剂为____。
②资料显示:该温度下,0.1molL-1的AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为____。
③小组同学继续进行实验,证明了2号试管得出的结论正确。实验如下:取100mL0.1molL-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉井搅拌,分别插入pH传感器和NO3-传感器(传感器可检测离子浓度),得到如图图示,其中pH传感器测得的图示为___(填“图甲”或“图乙”)。
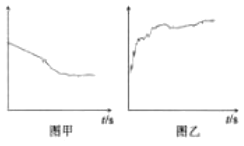
④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为___。
Ⅱ.探究Fe3+产生的原因
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化。小组同学设计不同实验方案对此进行验证。
(3)方案一;取出少量黑色固体,洗涤后___(填操作和现象),证明黑色固体中有Ag。
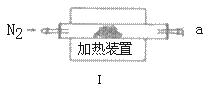
(4)方案二:按图连接装置,一段时间后取出左侧烧杯溶液,加人KSCN溶液,溶液变F红。该实验现象____(填“能“或“不能“)证明Fe2+可被Ag+氧化,理由为__。