题目内容
4.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol(1)要提高CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.充入H2 e.充入惰性气体 f.分离出甲醇
(2)在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 平衡 时数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的热量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
A.2c1>c3 B.a+b<90.8 C.2p2<p3 D.α1+α3<1.
分析 (1)要提高CO的转化率,可以采取措施使平衡向正反应移动,据此结合选项解答;
(2)A、甲、丙相比较,把甲等效为开始加入1molCH3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH3OH(g)?CO(g)+2H2(g),平衡向生成甲醇的方向移动;
B、由题目可知生成1molCH3OH的能量变化为$\frac{454kJ}{5}$=90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,计算反应热数值,据此判断;
C、比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)?CO(g)+2H2(g),平衡向生成甲醇的方向移动;
D、甲、乙处于相同的平衡状态,则α1+α2=1,由C的分析可知α2>α3,据此判断.
解答 解:(1)a.升温,平衡向逆反应方向移动,CO的转化率的减小,故a错误;
b.加入催化剂,平衡不移动,转化率不变,故b错误;
c.增加CO的浓度,CO的转化率的减小,故c错误;
d.恒容充入H2,平衡向正反应方向移动,转化率增大,故d正确;
e.恒压充入惰性气体,平衡不移动,转化率不变,故e错误;
f.分离出甲醇,平衡向正反应方向移动,转化率增大,故f正确.
故答案为:df;
(2)A、甲、丙相比较,把甲等效为开始加入1molCH3OH,丙中甲醇的物质的量为甲的2倍,压强增大,对于反应CH3OH(g)?CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2c1<c3,故A错误;
B、由题目可知生成1molCH3OH的能量变化为$\frac{454kJ}{5}$=90.8kJ,甲、乙平衡状态相同,令平衡时甲醇为nmol,对于甲容器,a=90.8n,等于乙容器b=90.8(1-n),故a+b=90.8,故B错误;
C、比较乙、丙可知,丙中甲醇的物质的量为乙的2倍,压强增大,对于反应CH3OH(g)?CO(g)+2H2(g),平衡向生成甲醇的方向移动,故2p2>p3,故C错误;
D、甲、乙处于相同的平衡状态,则α1+α2=1,由C的分析可知α2>α3,所以a1+a3<1,故D正确,
故答案为:D.
点评 本题考查较为综合,涉及化学平衡的移动原理以及等效平衡问题,难度较大,注意(2)题为易错点、难点,注意理解等效平衡问题.

| A. | 用Cl2对自来水进行消毒杀菌 | |
| B. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| C. | 用SO2漂白食品 | |
| D. | 用小苏打(NaHCO3)发酵面团制作馒头 |
| A. | 碳酸钙和盐酸反应:CO32-+2H-═H2O+CO↑ | |
| B. | 将Fe2O3溶于稀盐酸中:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 向稀盐酸溶液中加入铁粉:3Fe+6H-═3Fe3++3H2↑ | |
| D. | 把少量钠投人水中:Na+H2O═OH-+H2↑ |
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )| A. | 1molN2(g)和1molO2(g)反应放出的能量为180 kJ | |
| B. | 1molN2(g)和1molO2(g)具有的总能量小于2 molNO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和 O2混合能直接生成NO | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |

 .
.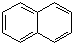 )的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氢.
)的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氢.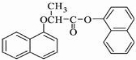 .
. ,写出以苯酚和乙醇为原料制备
,写出以苯酚和乙醇为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH. 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)
碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)