题目内容
19.下列离子方程式的书写正确的是( )| A. | 碳酸钙和盐酸反应:CO32-+2H-═H2O+CO↑ | |
| B. | 将Fe2O3溶于稀盐酸中:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 向稀盐酸溶液中加入铁粉:3Fe+6H-═3Fe3++3H2↑ | |
| D. | 把少量钠投人水中:Na+H2O═OH-+H2↑ |
分析 A.碳酸钙为难溶物,离子方程式中碳酸钙不能拆开,应该保留化学式;
B.氧化铁与盐酸反应生成氯化铁和水;
C.铁与稀盐酸反应生成氯化亚铁,不是生成铁离子;
D.2mol钠完全反应生成1mol氢气,该反应不满足电子守恒.
解答 解:A.碳酸钙与盐酸反应生成氯化钙、二氧化碳气体和水,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故A错误;
B.将Fe2O3溶于稀盐酸中的离子方程式为:Fe2O3+6H+═2Fe3++3H2O,故B正确;
C.向稀盐酸溶液中加入铁粉,反应生成氯化亚铁和氢气,正确的离子方程式为:Fe+2H-═Fe2++H2↑,故C错误;
D.钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,题目难度中等,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,C为易错点,注意铁与非氧化性的酸反应生成的是亚铁离子.

练习册系列答案
相关题目
4.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol
(1)要提高CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.充入H2 e.充入惰性气体 f.分离出甲醇
(2)在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温恒容,测得反应达到平衡时的有关数据如表:
下列说法正确的是D.
A.2c1>c3 B.a+b<90.8 C.2p2<p3 D.α1+α3<1.
(1)要提高CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.充入H2 e.充入惰性气体 f.分离出甲醇
(2)在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 平衡 时数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的热量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
A.2c1>c3 B.a+b<90.8 C.2p2<p3 D.α1+α3<1.
11.112号元素是上世纪末制造出来的新元素,其原子质量数为277.关于该元素的下列叙述正确的是( )
| A. | 该元素可能有放射性 | |
| B. | 该元素位于元素周期表中的第IIA族 | |
| C. | 其中子数与质子数之差为165 | |
| D. | 其原子质量是12C原子质量的277倍 |
8.X元素原子的核电荷数为n,X2-离子和Y3+离子的电子层结构相同,则Y原子的质子数为( )
| A. | n+1 | B. | n+2 | C. | n+3 | D. | n+5 |
9.最近,环境保护部向媒体公布了2015年“环境日”“践行绿色生活”主题,该主题旨在增强全民环境意识、节约意识、生态意识,选择低碳、节俭的绿色生活方式和消费模式,形成人人、事事、时时崇尚生态文明的社会新风尚,为生态文明建设奠定坚实的社会和群众基础.下列不符合这一主题的是( )
| A. | 推广节能灯和LED灯泡替代一般白炽灯 | |
| B. | 大力发展地铁,轻轨电车等城市公共交通 | |
| C. | 鼓励购买大排量家庭用燃油汽车 | |
| D. | 提倡使用手帕,减少纸巾的使用 |







 、
、 、
、 、
、 .
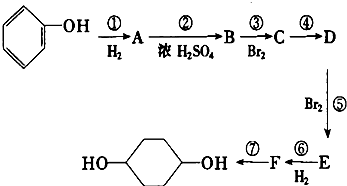
.
 、D
、D .
.
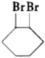 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ .
.