题目内容
13.(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式.FeSO4+HNO3→Fe(NO3)3+Fe2(SO4)3+N2O+H2O
(2)反应物中发生氧化反应的物质是FeSO4,被还原的元素是N.
(3)反应中0.5mol 氧化剂得到2mol 电子.
分析 (1)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,能将还原性的FeSO4氧化为Fe2(SO4)3,水在生成物中,以此组成一个未配平的化学方程式;
(2)反应物中所含元素化合价升高的物质被氧化;所含元素化合价降低的被还原;
(3)根据化合价变化数目计算0.5mol氧化剂发生还原时转移电子数.
解答 解:(1)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,能将还原性的FeSO4氧化为Fe2(SO4)3,水在生成物中,
组成一个未配平的化学方程式为:FeSO4+HNO3→Fe(NO3)3+Fe2(SO4)3+N2O+H2O,
故答案为:HNO3;Fe(NO3)3;Fe2(SO4)3;N2O;
(2)依据方程式:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O↑+15H2O,可知:硫酸亚铁中的二价铁离子化合价升高,所以硫酸亚铁被氧化;
化合价降低的元素被还原,反应中硝酸中N元素化合价由+5价降低到+1价,被还原;
故答案为:FeSO4;N;
(3)30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,硝酸为氧化剂,由方程式可知:
HNO3~0.5N2O~转移电子数4,
0.5mol 2mol;
故答案为:2.
点评 本题考查氧化还原反应化学方程式的书写,侧重于从化合价分析氧化产物和还原产物,从原子守恒确定其他反应物或产物,根据根据电子守恒和质量守恒来配平方程式,根据方程式进行计算,注意对基本概念的掌握,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol
(1)要提高CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.充入H2 e.充入惰性气体 f.分离出甲醇
(2)在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温恒容,测得反应达到平衡时的有关数据如表:
下列说法正确的是D.
A.2c1>c3 B.a+b<90.8 C.2p2<p3 D.α1+α3<1.
(1)要提高CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.充入H2 e.充入惰性气体 f.分离出甲醇
(2)在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 平衡 时数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的热量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
A.2c1>c3 B.a+b<90.8 C.2p2<p3 D.α1+α3<1.
1.经研究发现含白蚁信息素的物质有: (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯), (3,7-二甲基-1-辛烯),家蚕的信息素为:CH3(CH2)2CH=CHCH=CH(CH2)8CH3.下列说法正确的是( )
(3,7-二甲基-1-辛烯),家蚕的信息素为:CH3(CH2)2CH=CHCH=CH(CH2)8CH3.下列说法正确的是( )
 (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯), (3,7-二甲基-1-辛烯),家蚕的信息素为:CH3(CH2)2CH=CHCH=CH(CH2)8CH3.下列说法正确的是( )
(3,7-二甲基-1-辛烯),家蚕的信息素为:CH3(CH2)2CH=CHCH=CH(CH2)8CH3.下列说法正确的是( )| A. | 2,4-二甲基-1-庚烯与l-庚烯互为同分异构体 | |
| B. | 家蚕信息素与1molBr2加成产物只有3种 | |
| C. | 以上三种信息素均不能使溴的四氯化碳褪色 | |
| D. | 以上三种信息素都是乙烯的同系物 |
8.X元素原子的核电荷数为n,X2-离子和Y3+离子的电子层结构相同,则Y原子的质子数为( )
| A. | n+1 | B. | n+2 | C. | n+3 | D. | n+5 |
18.下列物质属于电解质的是( )
| A. | 干燥CuSO4 | B. | CO2 | C. | 食盐水 | D. | Fe |
5.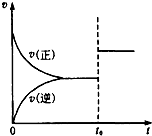 可逆反应aX(g)+bY(g)?cZ(g),在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)和时间(t)的关系如图所示.下列说法中正确的是( )
可逆反应aX(g)+bY(g)?cZ(g),在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)和时间(t)的关系如图所示.下列说法中正确的是( )
 可逆反应aX(g)+bY(g)?cZ(g),在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)和时间(t)的关系如图所示.下列说法中正确的是( )
可逆反应aX(g)+bY(g)?cZ(g),在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)和时间(t)的关系如图所示.下列说法中正确的是( )| A. | 若a+b=c,则t0时只增大了反应物的浓度 | |
| B. | 若a+b=c,则t0时只升高了温度 | |
| C. | 若a+b≠c,则t0时只增大了容器的压强 | |
| D. | 若a+b≠c,则t0时只加入了催化剂 |
3.下列反应可以设计成原电池的是( )
| A. | CH4+2O2═CO2+2H2O | B. | NaOH+HCl═NaCl+H2O | ||
| C. | Zn+CuSO4═Cu+ZnSO4 | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
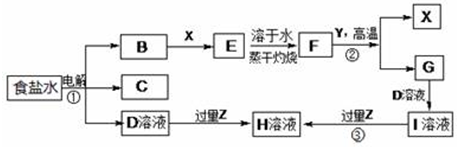
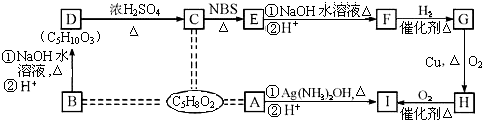
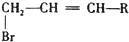
 、HOOCCH2CH2CH2CHO.
、HOOCCH2CH2CH2CHO.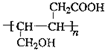 .
.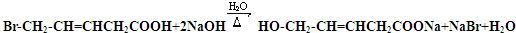 .
.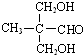 .
.