题目内容
【题目】某药物中含有As、Cu、H、O、Cl、Fe等元素。
(1)Cu单质在不同条件下可形成晶体和非晶体,可通过______区分晶体和非晶体;基态Cu原子的价电子排布式为____,基态Cu原子的核外电子排布中有___对自旋状态相反的电子。
(2)CH4分子中C原子的杂化方式为____,NH3沸点比CH4高的原因是________。
(3)酸性:H3AsO4___________H3AsO3,原因______________。
(4)H3O+、H2O相比较,键角较大的是______,其原因是_____________。
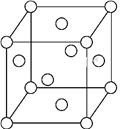
(5)一种Fe晶体晶胞如图所示,晶胞边长为a cm,已知该晶体的密度为ρ g·cm-3,Fe的相对原子质量为M,NA为阿伏加德罗常数的值,NA=____(列式表示即可)。
【答案】 X射线衍射实验 3d104s1 14 sp3杂化 氨分子之间可以形成氢键,而甲烷分子之间只存在范德华力 > H3AsO4中的非羟基氧原子比H3AsO3中多,H3AsO4中As对电子的吸引力更强,使O—H键更易断裂,电离出H+ H3O+ H3O+、H2O中O原子都是sp3杂化,H2O中O原子有2对孤电子对,H3O+中O原子有1对孤电子对,孤电子对越多,对成键电子对的排斥力越大,键角越小 ![]()
【解析】(1)区分晶体和非晶体,可通过X射线衍射实验区分,铜是29号元素,基态Cu原子的价电子排布式为3d104s1,29个电子占据15个轨道,其中14个轨道中的电子自旋状态相反,故答案为:X射线衍射实验;3d104s1;14;
(2)CH4分子中C原子的价层电子对数=4,采用sp3杂化,氨分子之间可以形成氢键,而甲烷分子之间只存在范德华力,使得NH3沸点比CH4高,故答案为:sp3杂化;氨分子之间可以形成氢键,而甲烷分子之间只存在范德华力;
(3) H3AsO4中的非羟基氧原子数目大于H3AsO3,酸性:H3AsO4>H3AsO3,故答案为:>;H3AsO4中的非羟基氧原子比H3AsO3中多,H3AsO4中As对电子的吸引力更强,使O—H键更易断裂,电离出H+;
(4) H3O+、H2O中O原子都是sp3杂化,H2O中O原子有2对孤电子对,H3O+中O原子有1对孤电子对,孤电子对越多,对成键电子对的排斥力越大,键角越小,因此H3O+、H2O相比较,键角较大的是H3O+,故答案为:H3O+;H3O+、H2O中O原子都是sp3杂化,H2O中O原子有2对孤电子对,H3O+中O原子有1对孤电子对,孤电子对越多,对成键电子对的排斥力越大,键角越小;
(5)根据晶胞结构图,1个晶胞中含有的铁原子数=8×![]() +6×
+6×![]() =4,因此晶体的密度为ρ g·cm-3=
=4,因此晶体的密度为ρ g·cm-3=![]() ,解得NA=
,解得NA=![]() ,故答案为:
,故答案为: ![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的相差4 |
F 是前四周期原子电子排布图中单电子数最多的元素 |
G在周期表的第十一列 |
(1)B基态原子的电子排布式为;F基态原子的价电子排布式为;G基态原子的最外层电子排布图为 .
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是(用元素符号填空).
(3)B、D的电负性相对大小:BD(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有种,位于p区的有种.
(5)DE3的电子式为 .