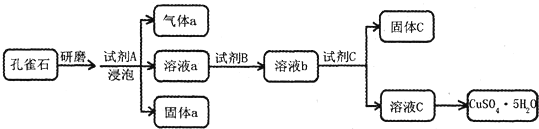
题目内容
6.某同学按如下实验流程提取海带中的碘,下列有关说法正确的是( )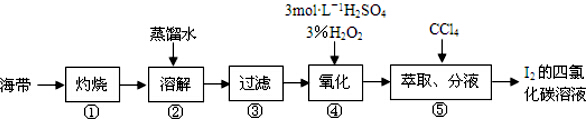
| A. | 第③步所需的主要玻璃仪器有:玻璃棒、烧杯、分液漏斗 | |
| B. | 第④步的离子反应方程式:H2O2+2I-+2H+=I2+2H2O | |
| C. | 第⑤步的CCl4可换成苯或酒精 | |
| D. | 该流程中分离出的碘可直接用作“加碘”食盐的碘添加剂 |
分析 海带灼烧加入蒸馏水溶解过滤除去不溶性杂质,加入稀硫酸酸化加入过氧化氢氧化碘离子为碘单质,加入四氯化碳萃取分液得到碘单质的四氯化碳溶液,蒸馏得到碘单质,
A、步骤③是过滤操作;
B、过氧化氢在酸性溶液中氧化碘离子为碘单质;
C、酒精和水混溶不能做萃取剂;
D、加碘食盐的碘添加剂是KIO3.
解答 解:海带灼烧加入蒸馏水溶解过滤除去不溶性杂质,加入稀硫酸酸化加入过氧化氢氧化碘离子为碘单质,加入四氯化碳萃取分液得到碘单质的四氯化碳溶液,蒸馏得到碘单质,
A、第③步是过滤操作,所需的主要玻璃仪器有:玻璃棒、烧杯、漏斗,故A错误;
B、第④步的离子反应方程式:H2O2+2I-+2H+=I2+2H2O,故B正确;
C、第⑤步为萃取分液分离碘单质,可以用苯换成CCl4 ,酒精易溶于水不能再溶液中分层,不能做萃取剂,故C错误;
D、加碘食盐的碘添加剂是KIO3,不是碘单质,故D错误;
故选B.
点评 本题考查海带成分中碘的检验,注意掌握萃取和分液的使用条件,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 46 g NO2含有氧原子数为2NA | |
| B. | 常温常压下,22.4 L N2含有的分子数为NA | |
| C. | 1 L 1 mol•L-1 Al2(SO4)3溶液中含SO${\;}_{4}^{2-}$数目为NA | |
| D. | 1 mol Fe在足量Cl2中燃烧,转移电子数为2NA |
11.下列过程中△H大于零的是( )
| A. | 碳的燃烧 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |

 Ⅰ.某学习小组用乙醇与氢溴酸为原料制备溴乙烷.
Ⅰ.某学习小组用乙醇与氢溴酸为原料制备溴乙烷.