题目内容
【题目】下列表示资源开发、回收、利用原理的反应方程式不正确的是( )
A. 海水提溴时用SO2吸收Br2蒸气:SO2+Br2+2H2O=2HBr+H2SO4
B. 将煤气化为可燃性气体:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
C. 用过量NaOH溶液吸收烟气中的SO2:SO2+NaOH=NaHSO3
D. 可以用铝和氧化铁制备铁单质:2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
【答案】C
【解析】分析:二氧化硫具有还原性,可以和溴单质发生氧化还原反应生成氢溴酸和硫酸;焦炭在高温下可以和水蒸气发生反应生成氢气和一氧化碳,少量的二氧化硫和强碱反应生成的是亚硫酸盐;铝和氧化铁反应制备铁单质。
A.二氧化硫可以和溴单质发生氧化还原反应生成氢溴酸和硫酸,即SO2+Br2+2H2O=2HBr+H2SO4,故A正确;B.焦炭在高温下可以和水蒸气发生反应生成氢气和一氧化碳,故B正确,少量的二氧化硫和强碱反应生成的是亚硫酸盐,即C(s)+H2O(g)![]() CO(g)+H2(g),故B错误; C.用过量NaOH溶液吸收烟气中的SO2:SO2+2NaOH=Na2SO3+H2O, 故C错误;D.可以用铝和氧化铁反应制备铁单质即2Al+Fe2O3
CO(g)+H2(g),故B错误; C.用过量NaOH溶液吸收烟气中的SO2:SO2+2NaOH=Na2SO3+H2O, 故C错误;D.可以用铝和氧化铁反应制备铁单质即2Al+Fe2O3![]() 2Fe+Al2O3,故D正确;本题答案选C。
2Fe+Al2O3,故D正确;本题答案选C。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】T K时,向2.0 L恒容密闭容器中充入0.10 mol COCl2,发生反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
下列说法正确的是( )
A. 保持其他条件不变,升高温度,平衡时c(Cl2)=0.038 mol·L-1,则反应的ΔH<0
B. 反应在前2 s的平均速率v(CO)=0.015 mol·L-1·s-1
C. 保持其他条件不变,起始时向容器中充入0.12 mol COCl2、0.06 mol Cl2和0.06 mol CO,反应达到平衡前的速率:v正<v逆
D. 保持其他条件不变,起始时向容器中充入0.10 mol Cl2和0.08 mol CO,达到平衡时,Cl2的转化率大于60%
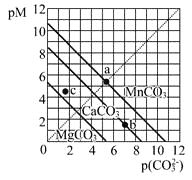
【题目】钴酸锂废极片中钴回收的某种工艺流程如下图所示,其中废极片的主要成分为钴酸锂(LiCoO2)和金属铝,最终可得到Co2O3及锂盐。
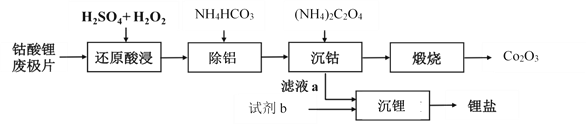
(1) “还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,请将该反应的化学方程式补充完整:2LiCoO2+3H2SO4+□ ![]() □CoSO4+□ +□ + □ 。__________
□CoSO4+□ +□ + □ 。__________
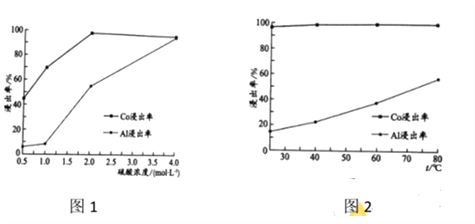
(2) “还原酸浸”过程中,Co、Al浸出率(进入溶液中的某元素质量占固体中该元素总质量的百分数)受硫酸浓度及温度(t)的影响分别如图1和图2所示。工艺流程中所选择的硫酸浓度为2 mol.L-1,温度为80 oC,推测其原因是________。
A. Co的浸出率较高 B. Co和Al浸出的速率较快
C. Al的浸出率较高 D. 双氧水较易分解
(3)加入(NH4)2C2O4后得CoC2O4沉淀。写出CoC2O4沉淀在空气中高温煅烧得到Co2O3的反应的化学方程式:________。
(4)若初始投入钴酸锂废极片的质量为1 kg,煅烧后获得Co2O3的质量为83 g,已知Co的浸出率为90%,则钴酸锂废极片中钴元素的质量分数约为________(小数点后保留两位)。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1 mol·L-1,部分锂盐的溶解度数据如下表所示。
温度 | Li2SO4 | Li2CO3 |
0 oC | 36.1 g | 1.33 g |
100 oC | 24.0 g | 0.72 g |
结合数据分析,沉锂过程所用的试剂b是________(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,________,洗涤干燥。