题目内容
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=-lgc(M),pc(CO32-)=-lgc(CO32-)。下列说法正确的是
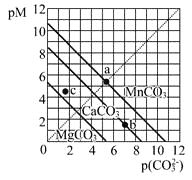
A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a点可表示MnCO3的饱和溶液,且c(Mn2+)> c(CO32-)
C. b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D. c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-)
【答案】D
【解析】试题分析:A、pM相等时,图线中p(CO32-)数值越大,实际浓度越小,因此,MgCO3、CaCO3、MnCO3的Ksp依次减小,故A错误;B、a点可表示MnCO3的饱和溶液,pM=p(CO32-),所以c(Mn2+)=c(CO32-),故B正确;C、b点可表示CaCO3的饱和溶液,pM<p(CO32-),所以c(Ca2+)>c(CO32-),故C错误;D、pM数值越大,实际浓度越小,则c点可表示MgCO3的不饱和溶液,pM>p(CO32-),所以c(Mg2+)<c(CO32-),故D错误。

练习册系列答案
相关题目