题目内容
【题目】如下图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
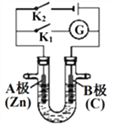
(1)断开K2,闭合K1,若所盛溶液为AgNO3溶液:则A为________极,B(石墨)极的电极反应式为________________。若所盛溶液为海水:则B极的电极反应式为______________________
(2)断开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则:
①A电极附近可观察到的现象是___________________________________,
检验B电极上产生的物质的方法_________________________________________,
该装置中发生的反应化学方程式是___________________________________。
②反应一段时间后打开K2,若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为1.12L,将溶液充分混合,溶液的pH为_____。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的______。
【答案】 负 Ag++e-=Ag O2+4e-+2H2O=4OH- 有气泡产生,溶液变红 将湿润的淀粉KI试纸(有色布条)放在B极支管处,若试纸变蓝(布条褪色),则产生Cl2. 2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 14 HCl
2NaOH+Cl2↑+H2↑ 14 HCl
【解析】试题分析:本题考查原电池和电解池的工作原理,实验现象的描述和电解的计算。
(1)断开K2,闭合K1,为原电池。A极(Zn极)为负极,B极(石墨)为正极。若所盛溶液为AgNO3溶液,石墨极的电极反应式为Ag++e-=Ag。若所盛溶液为海水,石墨极的电极反应式为O2+4e-+2H2O=4OH-。
(2)断开K1,闭合K2,为电解池,B与外加电源正极相连,B为阳极,A与外加电源负极相连,A为阴极。
①若所盛溶液为滴有酚酞的NaCl溶液,A电极的电极反应式为2H2O+2e-=H2↑+2OH-,A极附近可观察到的现象是:有气泡产生,溶液变红。B电极为惰性电极,B电极的电极反应式为2Cl--2e-=Cl2↑,检验Cl2的方法是:将湿润的淀粉KI试纸(或有色布条)放在B极支管处,若试纸变蓝(或布条褪色),则产生Cl2。装置中发生反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
②B极产生的气体为Cl2,n(Cl2)=1.12L![]() 22.4L/mol=0.05mol,根据反应生成n(OH-)=2n(Cl2)=2
22.4L/mol=0.05mol,根据反应生成n(OH-)=2n(Cl2)=2![]() 0.05mol=0.1mol,c(OH-)=0.1mol
0.05mol=0.1mol,c(OH-)=0.1mol![]() 0.1L=1mol/L,c(H+)=1
0.1L=1mol/L,c(H+)=1![]() 10-14mol/L,pH=14。根据原子守恒和“缺什么元素补什么元素”的原则,要使电解质溶液恢复到原状态,需向U形管内通入一定量的HCl气体。
10-14mol/L,pH=14。根据原子守恒和“缺什么元素补什么元素”的原则,要使电解质溶液恢复到原状态,需向U形管内通入一定量的HCl气体。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案