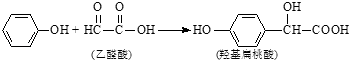��Ŀ����
����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/( mol��L1) | 0.1 | 0.2 | 0 |
ƽ��Ũ��/( mol��L1) | 0.05 | 0.05 | 0.1 |
����˵����ȷ����
A����Ӧ�ﵽƽ��ʱ��X��Y��ת�������
B������ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������
C����Ӧ�ɱ�ʾΪX+3Y![]() 2Z����ƽ�ⳣ��Ϊ1600
2Z����ƽ�ⳣ��Ϊ1600
D�����÷�Ӧ������Ӧ����Ϊ���ȷ�Ӧ�������¶ȣ���ѧ��Ӧ��������Ӧ��ƽ�ⳣ��Ҳ����
���𰸡�C
����������ͼ�����ݿ��Լ��㣬X��ת����Ϊ(0.05 mol��L1/0.1 mol��L1)��100%=50%��Y��ת����Ϊ (0.15 mol��L1/0.2 mol��L1)��100%=75%�� A������һ�����淴Ӧ��ƽ�ⳣ����Ũ�ȡ�ѹǿ�ʹ����أ�ֻ���¶��йأ���B����ͼ����X��Y��Z�ı仯������Ϊ0.05 mol��L1��0.15 mol��L1��0.1 mol��L1����Ũ�ȱ仯��Ϊ1��3��2������ѧ������֮��Ϊ1��3��2���ʸ÷�Ӧ�ɱ�ʾΪX+3Y![]() 2Z��������ƽ��ʱ�����ʵ�Ũ�ȴ���ƽ�ⳣ������ʽ���㣬
2Z��������ƽ��ʱ�����ʵ�Ũ�ȴ���ƽ�ⳣ������ʽ���㣬![]() =1600��C��ȷ�����ڸ÷�Ӧ������Ӧ����Ϊ���ȷ�Ӧ����ˣ����{�¶ȣ���ѧƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С��D����
=1600��C��ȷ�����ڸ÷�Ӧ������Ӧ����Ϊ���ȷ�Ӧ����ˣ����{�¶ȣ���ѧƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С��D����

��ϰ��ϵ�д�
 �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�
�����Ŀ