题目内容
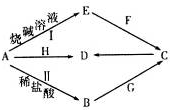
4.常见金属单质A可发生如图所示转化(部分反应物、产物和反应条件已略去).F是一种温室气体;气体G的水溶液显弱碱性;H是一种具有磁性的黑色氧化物;B、C、D、E四种化合物中含有一种相同的元素.请回答下列问题:
(1)写出F的电子式
 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.(2)写出反应I的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.该反应中的氧化剂是H2O.
(3)反应I、Ⅱ均有清洁能源H2产生.已知H2的燃烧热为286kJ•mol-1,18g水蒸气变成液态水放出44kJ的热量.其它相关数据如下表:
| O=O(g) | H-H(g) | H-O(g) | |
| 键能/kJ•mol-1 | 496 | x | 463 |
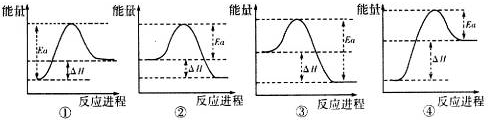
(4)写出A与H反应的化学方程式3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,实验测得该反应的焓变(△H)和活化能(Ea).下列能量关系图合理的是②③(填写序号).
(5)资料显示H可用于除去地下水中的TcO4-(99Tc具有放射性).在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该反应的离子方程式为3Fe3O4+TcO4-+13H2O+H+=TcO2+9Fe(OH)3.
分析 F是一种温室气体,则F为二氧化碳气体;金属A能够与烧碱溶液、盐酸溶液反应,其中A与烧碱溶液生成的E溶液能够与二氧化碳反应,则A为Al;H是一种具有磁性的黑色氧化物,则H为Fe3O4;H能够与金属铝反应生成D,且B,C,D,E四种化合物中含有一种相同的元素,则D为氧化铝、C为氢氧化铝;B为氯化铝;气体G的水溶液为碱性,则G为氨气,据此进行解答.
解答 解:F是一种温室气体,则F为CO2;金属A能够与烧碱溶液、盐酸溶液反应,其中A与烧碱溶液生成的E溶液能够与二氧化碳反应,则A为金属Al;H是一种具有磁性的黑色氧化物,则H为Fe3O4;H能够与金属铝反应生成D,且B,C,D,E四种化合物中含有一种相同的元素,则D为Fe2O3、C为Al(OH)3;B为AlCl3;气体G的水溶液为碱性,则G为NH3,
(1)F为二氧化碳,属于共价化合物,其分子中含有两个碳氧双键,二氧化碳的电子式为: ;
;
实验室制取氨气,通常采用氯化铵和氢氧化钙发生复分解反应,生成氯化钙、氨气和水制得氨气,化学反应方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为: ;Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
;Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(2)金属铝与氢氧化钠溶液反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,该反应的实质为铝与水反应生成氢氧化铝和氢气,生成的氢氧化铝具有两性,能够与氢氧化钠溶液反应,从而使该反应能够发生,所以该反应中的氧化剂为H2O,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;H2O;
(3)已知H2的燃烧热为286kJ•mol-1,故2mol氢气燃烧生成2mol液态水时放出热量为286kJ•mol-1×2=572kJ,
18g水蒸气变成液态水放出44kJ的热量,2mol液态水变为气态水吸收的热量为$\frac{2mol×18g/mol}{18g}$×44kJ=88kJ,
故2mol氢气燃烧生成2mol气态水时放出热量为:572kJ-88kJ=484kJ,
故热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,
所以△A=反应物总键能-生成物总键能=2xkJ/mol+496kJ/mol-4×463kJ/mol=-484kJ/mol,
解得:x=436,
故答案为:436;
(4)A与H反应的化学方程式为3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,该反应是放热反应,生成物能量低于反应物能量,结合图象分析活化能数值大于反应焓变判断,故图②③符合,
故答案为:3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3;②③;
(5)H为Fe3O4,在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱应为氢氧化铁,该反应的离子方程式为3Fe3O4+TcO4-+13H2O+H+=TcO2+9Fe(OH)3,
故答案为:3Fe3O4+TcO4-+13H2O+H+=TcO2+9Fe(OH)3.
点评 本题考查了无机推断,题目难度中等,侧重考查铝及其化合物性质,明确常见金属及其化合物性质为解答关键,注意掌握热化学方程式的焓变与键能之间的关系,试题培养了学生的分析能力及灵活应用能力.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 硝酸银溶液中滴入食盐水:Cl-+Ag+═AgCl↓ | |
| D. | 稀盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
| A. | c(NH${\;}_{4}^{+}$):c(NH3•H2O)比值增大 | B. | 所有离子浓度均减小 | ||
| C. | c(OH-):c(NH3•H2O)比值减小 | D. | 电离常数增大 |
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:
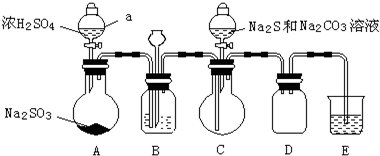
实验制备装置如图所示(省略夹持装置):
回答问题:
(1)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(2)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是观察B的气泡流速,旋转A分液漏斗活塞,通过控制硫酸流量而控制SO2流量.
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S、Na2CO3 Na2SO4 及Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3, 一定不含有Na2S、Na2SO4. |
| A. | 原子半径:W<X<Y<Z | |
| B. | X、Y、Z单质的熔点:Z<Y<X | |
| C. | 简单气态氢化物的热稳定性:Y<Z<W | |
| D. | Z元素的最高价氧化物对应水化物的分子中存在非极性共价键 |
 将一定量的二氧化碳通入100毫升某浓度的氢氧化钠溶液中得到溶液X,若向X中逐渐加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计二氧化碳溶解)( )
将一定量的二氧化碳通入100毫升某浓度的氢氧化钠溶液中得到溶液X,若向X中逐渐加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计二氧化碳溶解)( )| A. | 若OA=AB,则溶液X为碳酸钠溶液 | |
| B. | 若OA=0,则形成溶液X所发生反应的离子方程式为OH-+CO2=HCO3- | |
| C. | 若OA>AB,则溶液X中大量存在的阴离子为碳酸根离子和碳酸氢根离子 | |
| D. | 若3OA=AB,则溶液X中c(NaHCO3)=2c(Na2CO3) |
 ,丙的电子式为
,丙的电子式为 ,E在周期表中的位置为第三周期VA族.
,E在周期表中的位置为第三周期VA族. 在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸: