题目内容
2. 依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是( )
依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是( )| A. | 电极X的材料是Fe | |
| B. | 电解质溶液Y是AgNO3溶液 | |
| C. | 原电池工作时,X电极反应为:Fe-2e-=Fe2+ | |
| D. | 原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中 |
分析 由方程式Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)可知,反应中Cu2+被还原,应为正极反应,则电解质溶液为铜盐溶液,Fe被氧化,应为原电池负极反应,在装置图中X为Fe,Y为硝酸铜或硫酸铜溶液,以此解答该题.
解答 解:A、Fe被氧化,应为原电池负极反应,在装置图中X为Fe,故A正确;
B、反应中Cu2+被还原,电解质溶液Y是铜盐溶液,可以是硝酸铜溶液,故B错误;
C、原电池工作时,Fe在负极失电子,则X电极反应为:Fe-2e-=Fe2+,故C正确;
D、溶液中阴离子向负极移动,所以盐桥中的阴离子不断移向左池的氯化钠溶液中,故D正确;
故选B.
点评 本题考查原电池知识,为高考常见题型及高频考点,侧重于学生的分析能力和基本理论的理解和应用能力,难度不大,注意把握电极反应的判断和电极方程式的书写.

练习册系列答案
相关题目
12.资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:
实验制备装置如图所示(省略夹持装置):
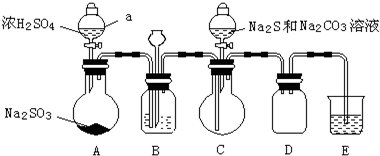
回答问题:
(1)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(2)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是观察B的气泡流速,旋转A分液漏斗活塞,通过控制硫酸流量而控制SO2流量.
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(4)完成对所得产品的检测的实验:
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:
实验制备装置如图所示(省略夹持装置):

回答问题:
(1)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(2)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是观察B的气泡流速,旋转A分液漏斗活塞,通过控制硫酸流量而控制SO2流量.
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3•5H2O.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S、Na2CO3 Na2SO4 及Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3, 一定不含有Na2S、Na2SO4. |
13. 将一定量的二氧化碳通入100毫升某浓度的氢氧化钠溶液中得到溶液X,若向X中逐渐加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计二氧化碳溶解)( )
将一定量的二氧化碳通入100毫升某浓度的氢氧化钠溶液中得到溶液X,若向X中逐渐加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计二氧化碳溶解)( )
 将一定量的二氧化碳通入100毫升某浓度的氢氧化钠溶液中得到溶液X,若向X中逐渐加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计二氧化碳溶解)( )
将一定量的二氧化碳通入100毫升某浓度的氢氧化钠溶液中得到溶液X,若向X中逐渐加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计二氧化碳溶解)( )| A. | 若OA=AB,则溶液X为碳酸钠溶液 | |
| B. | 若OA=0,则形成溶液X所发生反应的离子方程式为OH-+CO2=HCO3- | |
| C. | 若OA>AB,则溶液X中大量存在的阴离子为碳酸根离子和碳酸氢根离子 | |
| D. | 若3OA=AB,则溶液X中c(NaHCO3)=2c(Na2CO3) |
10.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:下列有关叙述正确的是( )


| A. | 贝诺酯分子中有三种含氧官能团 | |
| B. | 用FeCl3 溶液不能区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应 | |
| D. | 1mol贝诺酯与足量NaOH 溶液共热最多可消耗5molNaOH钠 |
17.下列反应的离子方程式中,正确的是( )
| A. | 稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+=BaSO4↓ | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| D. | 盐酸与饱和的澄清石灰水反应:H++OH-═H2O |
7.下列有关化学键的叙述,正确的是( )
| A. | 非金属元素组成的化合物中只含共价键 | |
| B. | 水溶液能导电的化合物一定是离子化合物 | |
| C. | 化合物MgO、SiO2、SO3中化学键的类型相同 | |
| D. | PH3分子稳定性低于NH3分子,因为N-H键键能高 |
 在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸: