题目内容
13.如图所示,在用锌片、铜片和稀硫酸组成的原电池装置中,下列说法正确的是( )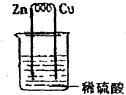
| A. | 铜片上的反应为:Cu-2e-=Cu2+ | B. | 锌片上的反应为:2H++2e-=H2↑ | ||
| C. | 锌片是负极,铜片是正极 | D. | 反应一段时间后,溶液的pH变小 |
分析 在用锌片、铜片和稀硫酸组成的原电池装置中,锌片的活泼性大于铜片的活泼性,所以锌片作负极,负极上锌失电子发生氧化反应,铜片作正极,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极.
解答 解:A.该装置中,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-═H2↑,故A错误;
B.该装置中,锌作负极,锌失电子发生氧化反应,电极反应式为:Zn-2e-═Zn2+,故B错误;
C.锌易失电子而作负极,则铜作正极,故C正确;
D.因为正极上氢离子得电子发生还原反应,所以反应一段时间后溶液的pH变大,故D错误;
故选C.
点评 本题考查了原电池原理,难度不大,明确正负极的判断、溶液的pH变化、电极反应式即可解答.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
4.下列说法或表示方法中正确的是( )
| A. | 全部由非金属元素组成的化合物中只含共价键 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 已知C(s,石墨)=C(s,金刚石)△H=+1.9 kJ/mol,则石墨比金刚石稳定 | |
| D. | 氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
1.硫酸铵分解的化学方程式为 3(NH4)2SO4═4NH3↑+3X↑+N2↑+6H2O,则X的化学式为( )
| A. | S | B. | O2 | C. | SO2 | D. | SO3 |
8.目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习.下列关于物质的类别中,不正确的是(括号内为类别)( )
| A. | Al2O3(两性氧化物) | B. | H2SO4(含氧酸) | C. | CH3COOH(烃) | D. | 食醋(混合物) |
18.1molAl分别与足量下列物质反应,所得金属的物质的量最少的是( )
| A. | WO3 | B. | Fe3O4 | C. | MnO2 | D. | Fe2O3 |
2.分子式为CH2Cl2的有机物同分异构体共有(不考虑立体异构)( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
3.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3.关于该物质的说法正确的是( )
| A. | 该物质属于两性氢氧化物 | |
| B. | 该药剂不适合于胃溃疡患者服用 | |
| C. | 1mol NaAl(OH)2CO3最多可消耗3molH+ | |
| D. | 该物质是Al(OH)3和Na2CO3的混合物 |
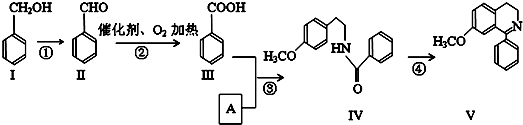
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2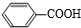 .
.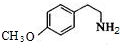 .
. .
.