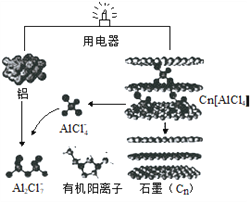
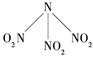
题目内容
【题目】四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍;D是形成化合物种类最多的元素。
(1)A、D形成的某种化合物甲是一种重要的化工产品,可用作水果和蔬菜的催熟剂,甲分子中σ键和π键数目之比为________;写出由甲制高聚物的反应方程式 。
(2)A、C形成的某种化合物乙分子中含非极性共价键,乙分子属于________(“极性分子”或“非极性分子”);其电子式________;将乙加入浅绿色氯化亚铜溶液中,溶液变为棕黄色,写出该反应的离子方程式______________。
(3)写出B的基态原子电子排布图为 。与PH3相比,BA3易液化的主要原因是_____________;
(4)笑气(B2C)是一种麻醉剂,有关理论认为B2C与DC2分子具有相似的结构。故B2C的空间构型是________,其为________(填“极性”或“非极性”)分子。
【答案】(1)5:1; nCH2=CH2![]()
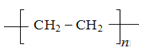
(2)极性分子;![]() ;
;
2Fe2+ +2H2O2+2H+=2Fe3++2H2O
(3)![]() ;NH3中有氢键。
;NH3中有氢键。
(4)直线型 ,非极性分子
【解析】试题分析:四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子,则A是H;B的基态原子s能级的总电子数比p能级的总电子数多1,这说明B的原子序数是7,则是N;C元素的原子最外层电子数是次外层的3倍,则C是O;D是形成化合物种类最多的元素,则D是碳元素。
(1)乙烯可用作水果和蔬菜的催熟剂,即甲是乙烯。由于单键都是σ键,而双键是由1个σ键和1个π键构成的,则根据乙烯的结构式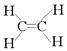 可知,分子中σ键和π键数目之比为5:1。乙烯含有碳碳双键,内发生加聚反应,则制高聚物的反应方程式为nCH2=CH2
可知,分子中σ键和π键数目之比为5:1。乙烯含有碳碳双键,内发生加聚反应,则制高聚物的反应方程式为nCH2=CH2![]()
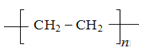 。
。
(2)A、C形成的某种化合物乙分子中含非极性共价键,则乙是双氧水,双氧水不是直线型结构,则乙分子属于极性分子,其电子式为![]() ;双氧水具有氧化性,能氧化亚铁离子,反应的化学方程式为2Fe2+ +2H2O2+2H+=2Fe3++2H2O。
;双氧水具有氧化性,能氧化亚铁离子,反应的化学方程式为2Fe2+ +2H2O2+2H+=2Fe3++2H2O。
(3)B的原子序数是7,根据核外电子排布规律可知,B的基态原子电子排布图为 。由于NH3中有氢键,是由与PH3相比,氨气易液化。
。由于NH3中有氢键,是由与PH3相比,氨气易液化。
(4)N2O与CO2分子具有相似的结构,CO2是直线型结构,则N2O的空间构型是直线型,其为非极性分子。

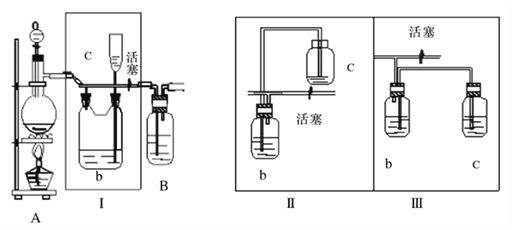
【题目】用下图装置进行①中实验,对应②中现象正确,且能达成相应实验目的的是( )
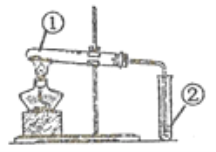
选项 | ①中实验 | ②中现象 | 实验目的 |
A | 将浸透石蜡油的石棉加热 | Br2的CCl4溶液褪色 | 石蜡裂解产物中含有烯烃 |
B | 加热NH4Cl固体 | 酚酞溶液变红 | 制备氨气并检验氨气性质 |
C | 加热NaHCO3与Na2CO3混合粉末 | 澄清石灰水变浑浊 | 验证NaHCO3具有热不稳定性 |
D | 加热铁粉及湿棉花 | 肥皂水中有气泡冒出 | Fe与H2O发生了置换反应 |
A. A B. B C. C D. D
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
HCN | S8 | SF6 | B12结构单元 | |
结构模型 示意图 |
|
|
|
|
备注 | — | 易溶于CS2 | — | 熔点1 873 K |
A. HCN的结构式为H—C≡N,分子中含有2个σ键和2个π键
B. 固态硫S8属于原子晶体
C. SF6是由极性键构成的非极性分子
D. 单质硼属原子晶体,结构单元中含有30个B—B键