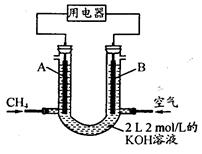
��Ŀ����
��15�֣���Դ�����ö�����̼�����ɼ�������������ŷţ��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��1����CO2��NH3Ϊԭ�Ͽɺϳɻ�������[CO(NH2)2]����֪��
��2NH3��g���� CO2��g���� NH2CO2NH4��s�� ��H �� -159.47 kJ��mol-1
��NH2CO2NH4��s���� CO(NH2)2��s���� H2O��g�� ��H �� +116.49 kJ��mol-1
��H2O��l���� H2O��g�� ��H ��+88.0 kJ��mol-1
��д��NH3��CO2�ϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽ ��
��2����һ�������£�������̼ת��Ϊ����ķ�Ӧ���£�
CO2(g)+4H2(g) CH4(g)+2H2O(g) ��H��0
CH4(g)+2H2O(g) ��H��0
����һ�ݻ�Ϊ2L�ĺ����ܱ������г���һ������CO2��H2����300��ʱ����������Ӧ���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�ΪCO2��0.2mol��L��1��H2��0.8mol��L��1��CH4��0.8mol��L��1��H2O��1.6mol��L��1����ʼ����CO2��H2�����ʵ����ֱ�Ϊ �� ��CO2��ƽ��ת����Ϊ ��
������������ͬ�ĺ��ݾ��ȣ������û�������������ܱ�����I��II����I�г���1 molCO2,��4 molH2����II�г���1 mol CH4��2 mol H2 O(g) ��300���¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ���� ������ĸ����
| A������I��II������Ӧ������ͬ |
| B������I��II��CH4�����ʵ���������ͬ |
| C������I��CO2�����ʵ���������II�еĶ� |
| D������I��CO2��ת����������II��CH4��ת����֮��С��1 |

�������������̵�����ת����ʽ�� ��
��������ⷴӦ���¶�С��900��ʱ����̼����ȷֽ�ΪCaO��CO2�������Ϊ����̼���ƣ��������ĵ缫��ӦʽΪ �������ĵ缫��ӦʽΪ ��
��1��2NH3��g���� CO2��g����CO(NH2)2��s����H2O��l����H ����130.98 kJ��mol��1 ��3�֣�
��2����2mol��1�֣���8mol��1�֣���80% ��2�֣� ��CD��2�֣�
��3����̫���ܺ͵���ת��Ϊ��ѧ�ܣ�2�֣�
��2CO32����4e��=2CO2��+O2����2�֣���3CO2+4e��=C+2CO32����2�֣�
���������������1���ɢ٣��ڣ��ۿɵã�2NH3(g)�� CO2(g)��CO(NH2)2(s)��H2O(l) ��H ����130.98 kJ��mol��1 ��3�֣�
��2���ټ�����ʼ�Ķ�����̼�����ʵ���Ϊxmol�����������ʵ���Ϊymol��
CO2(g) + 4H2(g)  CH4(g) + 2H2O(g) ��H��0
CH4(g) + 2H2O(g) ��H��0
��ʼ���ʵ����� xmol ymol 0 0
ת�����ʵ����� 1.6mol 6.4mol 1.6mol 3.2mol
ƽ�����ʵ����� 0.4mol 1.6mol 1.6mol 3.2mol
��ô��x��0.4mol��1.6mol��2.0mol y��6.4mol��1.6mol��8.0mol
CO2��ƽ��ת����Ϊ��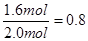
��A������I��II�е���ʼ��Ӧ�ﲻһ�����������Ӧ���ʲ�һ����ȣ�����B���������һ��������������ô�����������а����е�Ͷ���ǵ�Чƽ�⣬Ҳ����˵���������м���ĺ���Ӧ����ȣ�������һ�����ȵ�����������Ƕ�����̼���������ɼ����ˮ������Ӧ�Ƿ��ȷ�Ӧ���ų�������ʹ�����¶����ߣ������¶Ȼ�ʹ��ƽ�������ƶ���ʹ�ü���ĺ�����ǰ���ĵ�Чƽ��ʱ��Ҫ�ͣ���Ͷ������ˮ�����ɵ��Ƕ�����̼��������Ҫ���ȣ�ʹ����ϵ���¶Ƚ��ͣ����¶ȵĽ���ʹ��ƽ�������ƶ���ʹ�ü���ĺ�����ǰ���ĵ�Чƽ��ʱ��Ҫ�ߣ��������I��II��CH4�����ʵ�����������ͬ������C������I������ǰ����Чƽ��Ļ����������ƶ�������II������ǰ��ʶ����Чƽ��Ļ����������ƶ�����������I��CO2�����ʵ���������II�еĶ࣬��ȷ��D��������յ�Чƽ�������ǵĻ�������I��CO2��ת����������II��CH4��ת����֮�͵���1���������ھ��������У����ڵ�Чƽ��Ļ������ֱַ�������ƶ�����ˣ�����I��CO2��ת����������II��CH4��ת����֮��С��1����ȷ��
��3���ٴ�ͼ�п�֪װ���ǽ�̫���ܺ͵���ת��Ϊ��ѧ�ܣ�2�֣�
��������ʧȥ���ӵķ�Ӧ��2CO32����4e��=2CO2��+O2���������ǵõ����ӵķ�Ӧ���õ��ӵ�����ֻ���Ƕ�����̼��3CO2+4e��=C+2CO32����
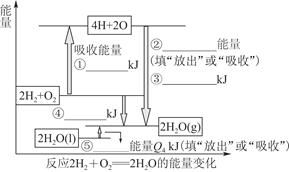
���㣺���鷴Ӧ�ȡ���ѧƽ���Լ��绯ѧ���й�֪ʶ��

 ��ǰ����ϵ�д�
��ǰ����ϵ�д���I����ͼ�ǹ�ҵ��������淋����̡�
��1��������C��ͨ�������Ŀ���� ��A��B��C��D�ĸ������еķ�Ӧ������������ԭ��Ӧ���� ������ĸ����
��2����֪��4NH3(g) + 3O2(g) = 2N2(g) +6H2O(g) ��H =��1266.8kJ/mol
N2(g) + O2(g) = 2NO(g) ��H =" +180.5" kJ/mol
д�������´��������Ȼ�ѧ����ʽ��
��II��ij����С��ͬѧ��ͭƬ����ϡ���ᣬ���ֿ�ʼʱ��Ӧ�dz�����һ��ʱ���Ӧ�������Լӿ졣��С��ͨ��ʵ��̽����ԭ��
��3���÷�Ӧ�����ӷ���ʽΪ___________________________________________________��
��4������������衣��ʵ���з�Ӧ�������Լӿ��ԭ�������_____________________��
A����Ӧ���ȵ����¶����� B��ѹǿ����
C���������д����� D����Ӧ��Ӵ��������
��5������̽�����ⶨ��Ӧ��������Һ��ͬʱ����¶ȣ�������±���
| ʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| �¶�/�� | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
���ʵ��Ŀ�ĺͱ������ݣ���ó��Ľ�����__________________________________��
��6����һ��̽�������������˽��ѧ��Ӧ�IJ�����м������ܶԷ�Ӧ�д����ã����������ʵ����Ʊ�����ʵ��Ŀ�IJ���������
| ʵ�� ��� | ͭƬ ����/g | 0.1mol��L-1�� �������/mL | ����ͭ ����/g | �������� ����/g | ʵ��Ŀ�� |
| �� | 5 | 20 | _______ | _______ | ʵ��ٺ͢�̽��_________��Ӱ�죻ʵ��ٺ͢�̽�����������Ӱ�졣 |
| �� | 5 | 20 | 0.5 | 0 | |
| �� | 5 | 20 | 0 | 0.5 |

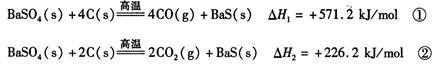
 2CO(g)�ġ�H = kJ/mol
2CO(g)�ġ�H = kJ/mol = ��[��֪��
= ��[��֪��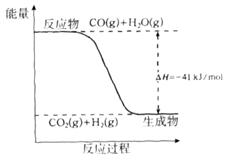
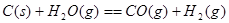


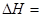
 Cl2(g) + CO(g) ��H =" +108" kJ/mol����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͼ��ʾ(��10 min��14 min��COCl2Ũ�ȱ仯������ʾ��)��
Cl2(g) + CO(g) ��H =" +108" kJ/mol����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͼ��ʾ(��10 min��14 min��COCl2Ũ�ȱ仯������ʾ��)��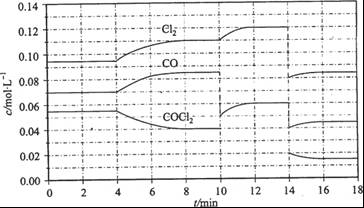
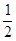 O2(g)��CO(g)��2H2(g) ��H2=��35.4 kJ��mol-1
O2(g)��CO(g)��2H2(g) ��H2=��35.4 kJ��mol-1 [Cu(NH3)3]Ac��CO ��H��0
[Cu(NH3)3]Ac��CO ��H��0