��Ŀ����
�о���ѧ��Ӧ�е������仯����Ҫ���塣�����ѧ��֪ʶ�ش��������⣺
��1����֪һ����̼��ˮ������Ӧ���̵������仯����ͼ��ʾ��
�ٷ�Ӧ���Ȼ�ѧ����ʽΪ____________________________________________��
����֪��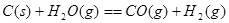
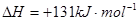
��
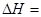
��2����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̡���ѧ���ļ������γɣ����1 mol��ѧ��ʱ�ͷţ������գ�����������֪��N��N���ļ�����948.9kJ��mol��1��H��H���ļ�����436.0 kJ��mol��1�� N��H���ļ�����391.55 kJ��mol��1����1/2N2(g) + 3/2H2(g) ="=" NH3(g) ��H = ��
��1����CO(g)+H2O(g)=CO2(g)+H2(g) ��H=��41KJ/mol�� �ڡ�H=+172KJ/mol��
��2����46.2 KJ/moL
���������������1���������仯ͼʾ��֪�÷�Ӧ���Ȼ�ѧ����ʽΪ����CO(g)+H2O(g)=CO2(g)+H2(g) ��H=��41KJ/mol���ڽ�CO(g)+H2O(g)=CO2(g)+H2(g)��ȥC(s)+H2O(g)=CO(g)+H2(g)�������ɵã�C(s)+CO2(g)-2CO(g) ��H=+172KJ/mol����2�����ݼ��ܵĶ��弰�뷴Ӧ�ȵĹ�ϵ��֪�� ��H="1/2��948.9kJ/mol+3/2��436.0" kJ/mol-3��391.55kJ/mol="��46.2" KJ/moL
���㣺�����Ȼ�ѧ����ʽ����д����˹���ɵ�Ӧ�ü���Ӧ���뻯ѧ���ļ��ܵĹ�ϵ��֪ʶ��

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д���֪��Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g)����H="a" kJ��mol-1,ƽ�ⳣ��ΪK;��Ӧ��CO(g)+1/2O2(g)
FeO(s)+CO(g)����H="a" kJ��mol-1,ƽ�ⳣ��ΪK;��Ӧ��CO(g)+1/2O2(g) CO2(g)����H="b" kJ��mol-1;��Ӧ��Fe2O3(s)+3CO(g)
CO2(g)����H="b" kJ��mol-1;��Ӧ��Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)����H="c" kJ��mol-1������ڲ�ͬ�¶���,Kֵ����:
2Fe(s)+3CO2(g)����H="c" kJ��mol-1������ڲ�ͬ�¶���,Kֵ����:
| �¶�/�� | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)��500 ��ʱ���з�Ӧ��,CO2����ʼŨ��Ϊ2 mol��L-1,CO��ƽ��Ũ��Ϊ����������
(2)��Ӧ��Ϊ��������(ѡ����ȡ����ȡ�)��Ӧ��
(3)700 ��ʱ��Ӧ�ٴﵽƽ��״̬,Ҫʹ��ƽ�������ƶ�,������������ʱ,���Բ�ȡ�Ĵ�ʩ����������(�����)��
A.��С��Ӧ����� B.ͨ��CO2 C.�¶����ߵ�900 �� D.ʹ�ú��ʵĴ���
E.����Fe����
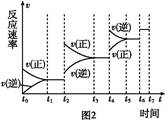
(4)����ͼ����Ϸ�Ӧ�ٵ�����������(�����)(ͼ��vΪ����,��Ϊ�������CO����,TΪ�¶���T1>T2)��
(5)�ɷ�Ӧ�ٺ͢ڿ����,��Ӧ2Fe(s)+O2(g)
 2FeO(s)�Ħ�H=����������
2FeO(s)�Ħ�H=���������� (6)�����ø�˹����д��Fe(����)��O2(����)�����õ�Fe2O3(����)���Ȼ�ѧ����ʽ:����
��15�֣���Դ�����ö�����̼�����ɼ�������������ŷţ��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ��
��1����CO2��NH3Ϊԭ�Ͽɺϳɻ�������[CO(NH2)2]����֪��
��2NH3��g���� CO2��g���� NH2CO2NH4��s�� ��H �� -159.47 kJ��mol-1
��NH2CO2NH4��s���� CO(NH2)2��s���� H2O��g�� ��H �� +116.49 kJ��mol-1
��H2O��l���� H2O��g�� ��H ��+88.0 kJ��mol-1
��д��NH3��CO2�ϳ����غ�Һ̬ˮ���Ȼ�ѧ����ʽ ��
��2����һ�������£�������̼ת��Ϊ����ķ�Ӧ���£�
CO2(g)+4H2(g) CH4(g)+2H2O(g) ��H��0
CH4(g)+2H2O(g) ��H��0
����һ�ݻ�Ϊ2L�ĺ����ܱ������г���һ������CO2��H2����300��ʱ����������Ӧ���ﵽƽ��ʱ�����ʵ�Ũ�ȷֱ�ΪCO2��0.2mol��L��1��H2��0.8mol��L��1��CH4��0.8mol��L��1��H2O��1.6mol��L��1����ʼ����CO2��H2�����ʵ����ֱ�Ϊ �� ��CO2��ƽ��ת����Ϊ ��
������������ͬ�ĺ��ݾ��ȣ������û�������������ܱ�����I��II����I�г���1 molCO2,��4 molH2����II�г���1 mol CH4��2 mol H2 O(g) ��300���¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ���� ������ĸ����
| A������I��II������Ӧ������ͬ |
| B������I��II��CH4�����ʵ���������ͬ |
| C������I��CO2�����ʵ���������II�еĶ� |
| D������I��CO2��ת����������II��CH4��ת����֮��С��1 |
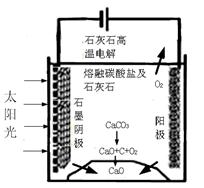
�������������̵�����ת����ʽ�� ��
��������ⷴӦ���¶�С��900��ʱ����̼����ȷֽ�ΪCaO��CO2�������Ϊ����̼���ƣ��������ĵ缫��ӦʽΪ �������ĵ缫��ӦʽΪ ��
�ҹ���ҵ����Ҫ�����������ַ�������β���еĺ�������
| ����1 | ȼú�м���ʯ��ʯ����SO2ת��ΪCaSO3��������ΪCaSO4 |
| ����2 | �ð�ˮ��SO2ת��ΪNH4HSO3��������Ϊ(NH4)2SO4 |
| ����3 | ��������ˮú����SO2��ԭΪS |
| ����4 | ��Na2SO3��Һ����SO2���ٵ��ת��ΪH2SO4 |
��1������1����֪���� CaO(s)��CO2(g)��CaCO3(s) ��H=��178.3 kJ/mol
��CaO(s)��SO2(g)��CaSO3(s) ��H=��402.0 kJ/mol
��2CaSO3(s)��O2(g)��2CaSO4(s) ��H=��2314.8 kJ/mol
д��CaCO3��SO2��Ӧ����CaSO4���Ȼ�ѧ����ʽ��____���˷�Ӧ��ƽ�ⳣ������ʽΪ��_____��
��2������2������Ʒ�к�������(NH4)2SO3��Ϊ�ⶨ(NH4)2SO4�ĺ���������Ա������²��裺
��ȷ��ȡ13.9 g ��Ʒ���ܽ⣻
������Һ�м���ֲ�����γ���Ĥ���õιܲ���Һ���¼���������ᣬ��ַ�Ӧ���ټ�����У�
�ۼ����������Ȼ�����Һ�����ˣ�
�ܽ�������ʵ�������
�ݳ������õ�����23.3 g�����㡣
����ڵ�Ŀ���ǣ�_____�����������ʵ����������Ʒֱ�Ϊ�� _____��_____����Ʒ��(NH4)2SO4������������____��������λ��Ч���֣���
��3�����о���������3�������������Ϊ0.75�ۼ�ú����CO��H2���������֮��Ϊ90%����SO2������SO2�������������15%������=30��40�ݡ���ƽ��ԭ�����ͱ��������Ϊ0.75��Ŀ���ǣ�_____��
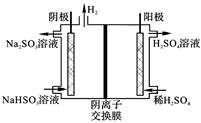
��4������4���ö��Ե缫�����Һ��װ����ͼ��ʾ�������缫��Ӧ����ʽΪ_____��
ijʵ��С����0.50 mol��L-1 NaOH��Һ��0.50 mol��L-1������Һ�����к��ȵIJⶨ��
������0.50 mol��L-1 NaOH��Һ
��1����ʵ���д�ԼҪʹ��245 mL NaOH��Һ��������Ҫ����NaOH�������� ��g��
��2������ͼ��ѡ�����NaOH��������Ҫ�������ǣ�����ĸ������ ������
| ���� | ������ƽ (������) | С�ձ� | ����ǯ | ������ | ҩ�� | ��Ͳ |
| ���� |  |  |  |  |  |  |
| ��� | a | b | c | d | e | f |
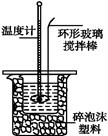
��1��д���÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽ�����к���Ϊ57.3 kJ��mol-1�� ���� ���� ���� ���� ��
��2��ȡ50 mL NaOH��Һ��30 mL������Һ����ʵ�飬ʵ���������±���
| �¶� ʵ������� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �¶Ȳ� ƽ��ֵ (t2-t1)/�� | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
���ϱ��е��¶Ȳ�ƽ��ֵΪ�� ��
�ڽ�����Ϊ0.50 mol��L-1 NaOH��Һ��0.50 mol��L-1������Һ���ܶȶ���1 g��cm-3���кͺ�������Һ�ı�����c="4.18" J��(g����)-1�����к��Ȧ�H=������ ��ȡС�����һλ����
������ʵ����ֵ�����57.3 kJ��mol-1��ƫ�����ƫ���ԭ������ǣ�����ĸ������������
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
 2SO3(g)��
2SO3(g)��
 O2(g)===H2O(l) ��H3����285.84 kJ��mol��1
O2(g)===H2O(l) ��H3����285.84 kJ��mol��1 CH3OH(g) ��H 1=��90.7 kJ��mol-1
CH3OH(g) ��H 1=��90.7 kJ��mol-1
 4N2(g)+6H2O(g) (��H <0)
4N2(g)+6H2O(g) (��H <0)