题目内容
(I)下图是工业生产硝酸铵的流程。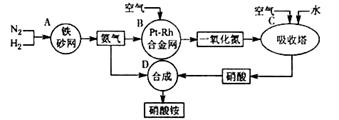
(1)吸收塔C中通入空气的目的是 。A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) +6H2O(g) △H =-1266.8kJ/mol
N2(g) + O2(g) = 2NO(g) △H =" +180.5" kJ/mol
写出氨高温催化氧化的热化学方程式:
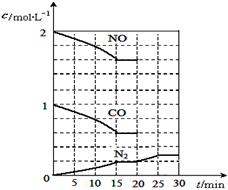
(II)某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(3)该反应的离子方程式为___________________________________________________。
(4)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 B.压强增大
C.生成物有催化作用 D.反应物接触面积增大
(5)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
结合实验目的和表中数据,你得出的结论是__________________________________。
(6)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请完成以下实验设计表并将实验目的补充完整:
| 实验 编号 | 铜片 质量/g | 0.1mol·L-1的 硝酸体积/mL | 硝酸铜 晶体/g | 亚硝酸钠 晶体/g | 实验目的 |
| ① | 5 | 20 | _______ | _______ | 实验①和②探究_________的影响;实验①和③探究亚硝酸根的影响。 |
| ② | 5 | 20 | 0.5 | 0 | |
| ③ | 5 | 20 | 0 | 0.5 |
(I)(1)使NO全部转化成HNO3 (或提供O2氧化NO)(2分); ABC(2分)(少1个扣1分,多1个没有分)
(2)4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905.8kJ/mol(3分)
4NO(g)+6H2O(g) △H=-905.8kJ/mol(3分)
(II)(3)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (3分)
(4)AC(2分)
(5)温度不是反应速率明显加快的主要原因。(2分)
(6)(2分)实验编号 铜片
质量/g0.1mol·L-1的
硝酸体积/mL硝酸铜
晶体/g亚硝酸钠
晶体/g实验目的 ① 5 20 0 0 实验①和②探究
Cu2+ 的影响;实验①和③探究亚硝酸根的影响。② 5 20 0.5 0 ③ 5 20 0 0.5
解析试题分析:(1)在整个生产流程中,第一次通入空气为了提高氨气的转化率,第二次是为了提高一氧化氮生成硝酸的转化率;整个流程中涉及的反应方程式有:①N2+3H2?2NH3②4NH3+5O2 =4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO
⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3,其中①②③④⑤属于氧化还原反应,即ABC属于氧化还原反应。
(2)氨高温催化氧化的热化学方程式可由①+2×②可得4NH3(g)+5O2(g)= 4NO(g)+6H2O(g),所以△H=-1266.8kJ/mol+2×180.5 kJ/mol=-905.8kJ/mol
(3)铜与稀硝酸反应的离子方程式:3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O
(4)影响化学反应速率的因素有压强、浓度、温度、催化剂、接触面积等,但是在铜与稀硝酸的反应中,压强不影响,硝酸的浓度随反应进行减小,铜的接触面积也减小,因此浓度、接触面积都不会加快反应速率;但是金属与酸的反应是放热反应,所以有可能是温度升高加快了反应速率,也有可能是生成物具有催化作用,生成的物质作催化剂加快了反应,故选AC。
(5)从表格中数据可知反应的80min中温度升高不多,因此温度对反应速率影响不大,不是主要因素。
(6)排除了温度因素后,探究生成物对反应的催化作用,所以生成物中或中间产物中可能有催化作用的是Cu2+ 和亚硝酸根,所以控制变量进行探究,实验①和②探究Cu2+的影响,实验①和③探究亚硝酸根的影响。
考点:本题考查的是氧还原反应、化学反应与能量、化学反应速率影响因素。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案(15分)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g)= NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s)= CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l)= H2O(g) △H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式 。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L—1,H2:0.8mol·L—1,CH4:0.8mol·L—1,H2O:1.6mol·L—1,起始充入CO2和H2的物质的量分别为 、 。CO2的平衡转化率为 。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充入1 molCO2,和4 molH2,在II中充入1 mol CH4和2 mol H2 O(g) ,300℃下开始反应。达到平衡时,下列说法正确的是 (填字母)。
| A.容器I、II中正反应速率相同 |
| B.容器I、II中CH4的物质的量分数相同 |
| C.容器I中CO2的物质的量比容器II中的多 |
| D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1 |
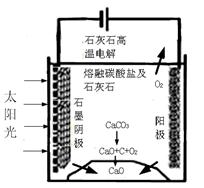
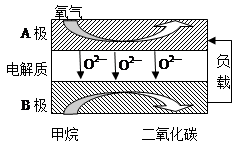
①上述生产过程的能量转化方式是 。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 ,阴极的电极反应式为 。
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
(2)已知:N2(g)+ O2(g)=2 NO(g) △H=+180 kJ ? mol-1
2NO(g)+2 CO(g)=N2(g) + 2 CO2(g) △H=-746 kJ ? mol-1
则反应CO(g) + O2(g)=CO2(g)的 △H= kJ ? mol-1。
O2(g)=CO2(g)的 △H= kJ ? mol-1。
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
(4)在固定体积的密闭容器中,1.0×103 kPa时,发生反应 N2(g)+3H2(g) 2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
① K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)。
a、容器内N2、H2、NH3的浓度之比为1:3:2
b、NH3的浓度保持不变
c、容器内压强保持不变
d、混合气体的密度保持不变
某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①上表中的温度差平均值为 ℃
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c="4.18" J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(14分)CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)金刚石和石墨燃烧反应中的能量变化如图所示。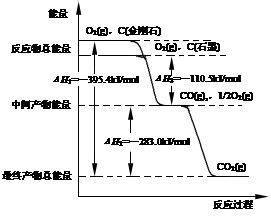
①在通常状况下,金刚石和石墨中, (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为 kJ·mol-1。
②石墨与CO2反应生成CO的热化学方程式: 。
(2)采用电化学法可将CO2转化为甲烷。试写出以氢氧化钾水溶液作电解质时,该转化的电极反应方程式 。
(3)CO2为原料还可合成多种物质。工业上常以CO2(g) 与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
2CO(g)+4H2 (g)  CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1。
CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1。
则:2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(l) △H= 。
CH3CH2OH(g)+3H2O(l) △H= 。
②下图是一种以烟道气为原料合成乙醇的工作原理示意图。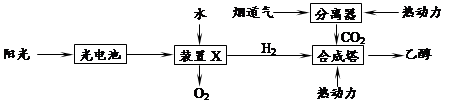
对上述流程的分析,下列说法正确的是 。
| A.该流程至少包含4种形式的能量转化 |
| B.装置X中阴极反应为:2H2O-4e-=4H++O2↑ |
| C.合成塔中生成乙醇的反应是化合反应 |
| D.流程设计体现了绿色化学思想 |

 CH3OH(g)
CH3OH(g)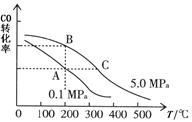
 CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
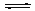 N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。