题目内容
按要求写出下列方程
(1)碳酸钠溶液呈碱性的原因,用离子方程表示 。
(2)用锌保护海底钢铁设施,其中负极发生的电极反应为: 。
(3)含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式 。
(4)氢氧化镁溶解在浓的氯化铵溶液,用离子方程表示 。
(5) Al(OH)3的电离反应方程式: 。
(1)CO32-+H2O HCO3-+OH- (2)Zn-2e-=Zn2+
HCO3-+OH- (2)Zn-2e-=Zn2+
(3)NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
(4)Mg(OH)2+2NH4+=2NH3·H2O+Mg2+ (5)H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
解析试题分析:(1)碳酸钠是强碱弱酸盐,溶于水电离出的CO32-水解,溶液显碱性,离子方程式为CO32-+H2O HCO3-+OH-。
HCO3-+OH-。
(2)锌的金属性强于铁,与铁构成原电池时锌是负极失去电子,被氧化。铁是正极,被保护,负极反应式为Zn-2e-=Zn2+。
(3)20.0 g NaOH的物质的量=20.0g÷40.0g/mol=0.5mol,与足量的盐酸反应生成0.5mol水,因此生成1mol水时放出的热量是28.7 kJ×2=57.4kJ。又因为中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以该反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol。
(4)氯化铵溶液中NH4+水解溶液显酸性,因此可以溶解氢氧化镁,反应的离子方程式为Mg(OH)2+2NH4+=2NH3·H2O+Mg2+。
(5)氢氧化铝是弱电解质,属于两性氢氧化物存在两种电离平衡,酸式电离和碱式电离,因此其电离方程式为H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-。
Al3++3OH-。
考点:考查盐类水解、金属的腐蚀与防护、中和热计算、溶解平衡以及氢氧化铝的电离

已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH="a" kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)
FeO(s)+CO(g) ΔH="a" kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g) CO2(g) ΔH="b" kJ·mol-1;反应③Fe2O3(s)+3CO(g)
CO2(g) ΔH="b" kJ·mol-1;反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH="c" kJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH="c" kJ·mol-1。测得在不同温度下,K值如下:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(2)反应①为 (选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900 ℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图像符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。

(5)由反应①和②可求得,反应2Fe(s)+O2(g)
 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。 (6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式: 。
(15分)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+ CO2(g)= NH2CO2NH4(s) △H = -159.47 kJ·mol-1
②NH2CO2NH4(s)= CO(NH2)2(s)+ H2O(g) △H = +116.49 kJ·mol-1
③H2O(l)= H2O(g) △H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式 。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH<0
CH4(g)+2H2O(g) ΔH<0
①向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L—1,H2:0.8mol·L—1,CH4:0.8mol·L—1,H2O:1.6mol·L—1,起始充入CO2和H2的物质的量分别为 、 。CO2的平衡转化率为 。
②现有两个相同的恒容绝热(与外界没有热量交换)密闭容器I、II,在I中充入1 molCO2,和4 molH2,在II中充入1 mol CH4和2 mol H2 O(g) ,300℃下开始反应。达到平衡时,下列说法正确的是 (填字母)。
| A.容器I、II中正反应速率相同 |
| B.容器I、II中CH4的物质的量分数相同 |
| C.容器I中CO2的物质的量比容器II中的多 |
| D.容器I中CO2的转化率与容器II中CH4的转化率之和小于1 |

①上述生产过程的能量转化方式是 。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 ,阴极的电极反应式为 。
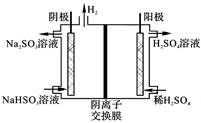
我国工业上主要采用以下四种方法降低尾气中的含硫量:
| 方法1 | 燃煤中加入石灰石,将SO2转化为CaSO3,再氧化为CaSO4 |
| 方法2 | 用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4 |
| 方法3 | 高温下用水煤气将SO2还原为S |
| 方法4 | 用Na2SO3溶液吸收SO2,再电解转化为H2SO4 |
(1)方法1中已知:① CaO(s)+CO2(g)=CaCO3(s) ΔH=-178.3 kJ/mol
②CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0 kJ/mol
③2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8 kJ/mol
写出CaCO3与SO2反应生成CaSO4的热化学方程式:____;此反应的平衡常数表达式为:_____。
(2)方法2中最后产品中含有少量(NH4)2SO3,为测定(NH4)2SO4的含量,分析员设计以下步骤:
①准确称取13.9 g 样品,溶解;
②向溶液中加入植物油形成油膜,用滴管插入液面下加入过量盐酸,充分反应,再加热煮沸;
③加入足量的氯化钡溶液,过滤;
④进行两步实验操作;
⑤称量,得到固体23.3 g,计算。
步骤②的目的是:_____。步骤④两步实验操作的名称分别为: _____、_____。样品中(NH4)2SO4的质量分数:____(保留两位有效数字)。
(3)据研究表明方法3的气配比最适宜为0.75[即煤气(CO、H2的体积分数之和为90%)∶SO2烟气(SO2体积分数不超过15%)流量=30∶40]。用平衡原理解释保持气配比为0.75的目的是:_____。
(4)方法4中用惰性电极电解溶液的装置如图所示。阳极电极反应方程式为_____。
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。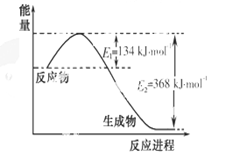
(2)已知:N2(g)+ O2(g)=2 NO(g) △H=+180 kJ ? mol-1
2NO(g)+2 CO(g)=N2(g) + 2 CO2(g) △H=-746 kJ ? mol-1
则反应CO(g) +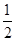 O2(g)=CO2(g)的 △H= kJ ? mol-1。
O2(g)=CO2(g)的 △H= kJ ? mol-1。
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
(4)在固定体积的密闭容器中,1.0×103 kPa时,发生反应 N2(g)+3H2(g) 2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
① K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)。
a、容器内N2、H2、NH3的浓度之比为1:3:2
b、NH3的浓度保持不变
c、容器内压强保持不变
d、混合气体的密度保持不变
 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中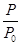 与时间t的关系如图所示。
与时间t的关系如图所示。
 [Cu(NH3)3]Ac?CO(aq)(△H<0)
[Cu(NH3)3]Ac?CO(aq)(△H<0)

 4N2(g)+6H2O(g) (△H <0)
4N2(g)+6H2O(g) (△H <0)
 N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。 