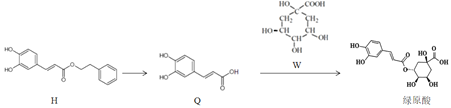
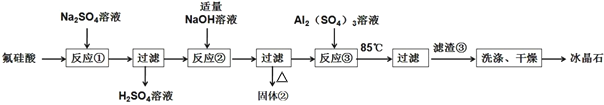
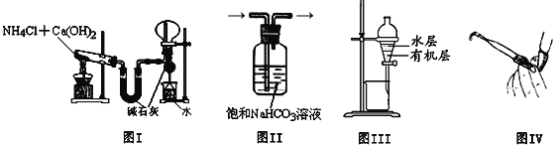
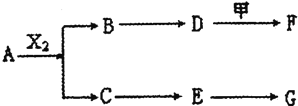题目内容
【题目】下列描述正确的是 ( )
①CS2为V形的极性分子 ②![]() 的立体构型为平面三角形③SF6中有6对完全相同的成键电子对 ④SiF4和
的立体构型为平面三角形③SF6中有6对完全相同的成键电子对 ④SiF4和![]() 的中心原子均采用sp3杂化
的中心原子均采用sp3杂化
A.①③B.②④C.①②D.③④
【答案】D
【解析】
①CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,属于直线形分子,是非极性分子,故①错误;
②ClO3-中Cl的价层电子对数=3+![]() (7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故②错误;
(7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故②错误;
③SF6中S-F含有一个成键电子对,所以SF6中含有6个S-F键,则分子中有6对完全相同的成键电子对,故③正确;
④SiF4中Si的价层电子对数=4+![]() (4-1×4)=4,SO32-中S的价层电子对数=3+
(4-1×4)=4,SO32-中S的价层电子对数=3+![]() (6+2-2×3)=4,所以中心原子均为sp3杂化,故④正确;
(6+2-2×3)=4,所以中心原子均为sp3杂化,故④正确;
③和④正确,故答案为D。

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目