题目内容
7.下列图象表示向AlCl3溶液中滴加NaOH溶液的过程中或NaAlO2溶液中滴加稀盐酸的过程中Al3+与AlO2-物质的量的变化曲线,实线表示Al3+物质的量的变化,虚线表示AlO2-物质的量的变化,其中正确的是( )| A. | 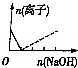 | B. | 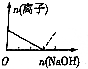 | C. | 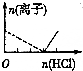 | D. | 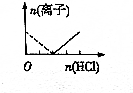 |
分析 向AlCl3溶液中滴加NaOH溶液的过程中,发生反应分别为:Al3++3OH-═Al(OH)3↓、OH-+Al(OH)3=AlO2-+2H2O;NaAlO2溶液中滴加稀盐酸的过程中Al3+与AlO2-的过程中发生的反应分别为:AlO2-+H++H2O═Al(OH)3↓、Al(OH)3+3H+═Al3++3H2O,据此进行判断.
解答 解:向AlCl3溶液中滴加NaOH溶液的过程中,发生反应分别为:Al3++3OH-═Al(OH)3↓、OH-+Al(OH)3=AlO2-+2H2O,根据反应可知,Al3+物质的量的变化过程中消耗的NaOH的物质的量与AlO2-物质的量达到最大消耗NaOH的物质的量之比为3:1,满足条件的图象为B,即A错误、B正确;
NaAlO2溶液中滴加稀盐酸的过程中Al3+与AlO2-的过程中发生的反应分别为:AlO2-+H++H2O═Al(OH)3↓、Al(OH)3+3H+═Al3++3H2O,则偏铝酸根离子完全反应消耗的NaOH的物质的量与铝离子的物质的量达到最大消耗NaOH的物质的量之比为1:3,C中为3:1,D中为1:1,故C、D错误;
故选B.
点评 本题考查了离子反应及其综合应用,题目难度中等,明确发生反应的实质为解答关键,注意熟练掌握铝及其化合物的性质,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
17.一定温度下将0.2mol气体A充入10L恒容密闭容器中,进行反应:2A(g)+B(g)?2C(g)+D(s)△H<0,一段时间后达到平衡,此反应过程中测定的数据如表所示,则下列说法正确的是( )
| t/min | 2 | 4 | 6 | 8 | 10 |
| n(A)/mol | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率ν(C)=0.02 mol•L-1•min-1 | |
| B. | 平衡后降低温度,反应达到新平衡前ν(逆)>ν(正) | |
| C. | 其他条件不变,10 min后再充入一定量的A,平衡正向移动,A的转化率变小 | |
| D. | 保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同 |
18.关于亚硝酸钠与氯化钠,下列叙述正确的是( )
| A. | 因亚硝酸钠有剧毒,所以不能用作食品添加剂 | |
| B. | 可用淀粉-KI试纸来鉴别一种盐溶液是亚硝酸钠还是氯化钠 | |
| C. | 能用硝酸银溶液来区别亚硝酸钠与氯化钠 | |
| D. | 因NaNO2具有较强的氧化性,可用酸性KMnO4溶液和FeCl2溶液鉴别NaCl与NaNO2 |
15.下列离子或化学方程式与所述事实相符且正确的是( )
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 用K37ClO3与浓盐酸反应制氯气:K37ClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$K37Cl+3Cl2+3H2O | |
| C. | 足量小苏打溶液与氢氧化钡溶液混合:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| D. | 向AlCl溶液中滴加过量的氨水:Al3++4OH-═[Al(OH)4]- |
2.有关下列装置图的叙述正确的是( )


| A. | 若X为粗铜,Y为硫酸铜,K接N,则此装置可以精炼铜 | |
| B. | 若X为铜,Y为浓硝酸,K接M,可以形成原电池,则铁为负极 | |
| C. | 若X为锌,则无论K接M还是N,铁都能被保护 | |
| D. | 若X为银,Y为FeCl3,K接N,则此装置可以在铁上镀银 |
9.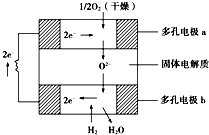 固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
 固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | 有O2参加反应的a极为电池的负极 | |
| B. | 电路中每转移2mole-,则消耗H2的体积为22.4L. | |
| C. | a极对应的电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 该电池的总反应式为2H2+O2$\frac{\underline{\;高温\;}}{\;}$2H2O |
10.分类法在化学学科发展中起到了非常重要的作用,下列分类标准合理的是( )
| A. | 根据是否含有氧元素,将物质分为氧化剂和还原剂 | |
| B. | 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 | |
| C. | 根据水溶液是否能够导电,将物质分为电解质和非电解质 | |
| D. | 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 |
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题: