题目内容
10.分类法在化学学科发展中起到了非常重要的作用,下列分类标准合理的是( )| A. | 根据是否含有氧元素,将物质分为氧化剂和还原剂 | |
| B. | 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 | |
| C. | 根据水溶液是否能够导电,将物质分为电解质和非电解质 | |
| D. | 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 |
分析 A.反应物中含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂;
B.分散系的分类依据是根据分散系微粒直径的大小;
C.电解质是指在水溶液里或熔化状态下能够导电的化合物,非电解质是指在水溶液里和熔化状态下都不能够导电的化合物;
D.氧化还原反应中有电子的转移,而非氧化还原反应物电子的转移.
解答 解:A.根据反应物中含元素化合价升降,将物质分为氧化剂和还原剂,故A错误;
B.分散系的分类依据是根据分散系中分散质粒子直径的大小,而不是否具有丁达尔现象,故B错误;
C.根据在水溶液里或熔化状态下能否导电,将物质分为电解质和非电解质,故C错误;
D.根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应,故D正确.
故选D.
点评 本题考查物质的分类,题目难度不大,注意物质的分类的依据,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
1.对于反应A(g)+3B(g)?2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
| A. | v(A)═0.01 mol/(L•s) | B. | v (B)═0.02 mol/(L•s) | ||
| C. | v (B)═0.60mol/(L•min) | D. | v (C)═1.0mol/(L•min) |
18.下列事实不能说明有机物分子中原子或原子团直接相连时而产生相互影响的是( )
| A. | 邻甲基苯酚能与NaOH溶液反应而苯甲醇不能 | |
| B. | 等物质的量的乙醇和乙二醇与足量的金属钠反应,后者产生的氢气比前者多 | |
| C. | 苯与液溴在催化剂存在下发生反应,而苯酚与浓溴水混合就能发生反应 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色而甲烷不能 |
5.下列关于胶体的说法正确的是( )
| A. | 胶体的分散质粒子能通过滤纸,而其他分散系的分散质粒子不能通过滤纸 | |
| B. | 氢氧化铁胶体、硫酸铜溶液用激光笔照射,均能观察到一条光亮的通道 | |
| C. | 胶体区分于溶液的本质特征是胶体的分散质粒子直径在1nm~100nm之间 | |
| D. | 氢氧化铝和氢氧化铁胶体可用于净水是因为它们具有强氧化性 |
15.化学是以实验为基础的学科,下列各图示实验不合理的是( )
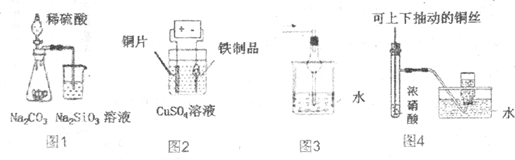

| A. | 图1为证明非金属性强弱:S>C>Si | |
| B. | 图2为在铁制品表面镀铜 | |
| C. | 图3可用于吸收氯化氢、溴化氢等气体 | |
| D. | 图4为制备并收集少量NO2气体 |
2.设NA为阿伏加德罗常数,下列说法中,正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16gCH4所含原子数目为NA | ||
| C. | 17gNH3所含电子数目为10NA | D. | 18g水所含分子数目为NA |
19.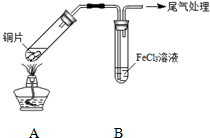 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
FeCl3溶液显酸性的原因是Fe3++3H2O?Fe(OH)3+3H+.写出装置A中产生SO2的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2?H2SO3,H2SO3?H++HSO3-,Fe3++HSO3-?Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为生成蓝色沉淀.
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验.
| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
(2)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象.将混合液放置12小时,溶液才变成浅绿色.
【查阅资料】Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+.生成Fe(HSO3)2+离子的反应为可逆反应.
解释SO2与FeCl3溶液反应生成红棕色Fe(HSO3)2+离子的原因:H2O+SO2?H2SO3,H2SO3?H++HSO3-,Fe3++HSO3-?Fe(HSO3)2+.
写出溶液中Fe(HSO3)2+离子与Fe3+反应的离子方程式:Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤③的实验.
| 步骤② | 往5mL 1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.加热、提高FeCl3溶液的酸性会缩短浅绿色出现的时间.
20.配合物在许多方面有着广泛的应用.下列叙述不正确的是( )
| A. | 以Mg2+为中心的大环配合物叶绿素能催化光合作用 | |
| B. | Fe2+的卟啉配合物是输送O2的血红素 | |
| C. | 三价铁离子和硫氰酸根离子形成的配离子常用于人造血液 | |
| D. | 钴离子的卟啉配合物是人体需要的一种维生素 |