题目内容
12.在一定温度和一定压强的容器中充入4升N2和H2的混合气体,反应达到平衡后,恢复到原温度,体积变为3.4升,容器内气体对相同条件下H2的相对密度为5.计算:反应达到平衡时V(NH3)=0.6升,反应前V(N2):V(H2)=1:3,N2的转化率为30%.分析 设起始时氮气体积为x L,平衡后气体体积减小了4L-3.4L=0.6L,则:
N2 (g)+3H2 (g)?2NH3(g) 体积减小△V=2
起始(L):x 4-x 0
变化(L):0.3 0.9 0.6 0.6
平衡(L):x-0.3 3.1-x 0.6
平衡时容器内气体对相同条件的氢气的相对密度为5,则相对分子质量为5×2=10,故$\frac{x-0.3}{3.4}$×28+$\frac{3.1-x}{3.4}$×2=10,解得x=1,据此解答.
解答 解:设起始时氮气体积为x L,平衡后气体体积减小了4L-3.4L=0.6L,则:
N2 (g)+3H2 (g)?2NH3(g) 体积减小△V=2
起始(L):x 4-x 0
变化(L):0.3 0.9 0.6 0.6
平衡(L):x-0.3 3.1-x 0.6
平衡时容器内气体对相同条件的氢气的相对密度为5,则相对分子质量为5×2=10,故$\frac{x-0.3}{3.4}$×28+$\frac{3.1-x}{3.4}$×2=10,解得x=1,
反应达到平衡时V(NH3)=0.6L,反应前V(N2):V(H2)=1L:(4-1)L=1:3,N2的转化率为$\frac{0.3L}{1L}$×100%=30%,
故答案为:0.6;1:3;30%.
点评 本题考查化学平衡的有关计算,难度不大,掌握三段式在化学平衡计算中应用,注意差量法的应用.

练习册系列答案
相关题目
10.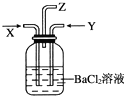 X气体为SO2和CO2的混合气体,Y气体为Cl2,它们同时通入盛有足量氯化钡溶液的洗气瓶中(如下图所示装置).下列说法正确的是( )
X气体为SO2和CO2的混合气体,Y气体为Cl2,它们同时通入盛有足量氯化钡溶液的洗气瓶中(如下图所示装置).下列说法正确的是( )
 X气体为SO2和CO2的混合气体,Y气体为Cl2,它们同时通入盛有足量氯化钡溶液的洗气瓶中(如下图所示装置).下列说法正确的是( )
X气体为SO2和CO2的混合气体,Y气体为Cl2,它们同时通入盛有足量氯化钡溶液的洗气瓶中(如下图所示装置).下列说法正确的是( )| A. | 洗气瓶中产生的沉淀是亚硫酸钡 | B. | 洗气瓶中产生的沉淀是碳酸钡 | ||
| C. | 洗气瓶中没有明显现象 | D. | 洗气瓶中有硫酸钡沉淀 |
7.在可逆反应2A(g)+3B(g)?xC(g)+yD(g)中,已知起始浓度A为5mol/L,B为3mo1/L,C的反应速率为0.5mol/(L•min),反应开始达到平衡需2min,平衡时D的浓度为0.5mol/L.关于此反应下列说法中正确的是( )
| A. | A和B的平衡浓度之比为5:3 | B. | A和B的平衡浓度之比为2:3 | ||
| C. | x=1 | D. | x:y=2:1 |
17. 减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
①已知:K(300℃)>K(350℃),则该反应是放热反应(填“放热”或“吸热”)
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有D
A.升高温度 B.恒容充入氦气 C.恒容再充入NO2 D.把恒容改为恒压,其它条件相同.
 减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
减少氮的氧化物在大气中的排放是环境保护的重要内容之一.(1)如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有D
A.升高温度 B.恒容充入氦气 C.恒容再充入NO2 D.把恒容改为恒压,其它条件相同.
1.对于反应A(g)+3B(g)?2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
| A. | v(A)═0.01 mol/(L•s) | B. | v (B)═0.02 mol/(L•s) | ||
| C. | v (B)═0.60mol/(L•min) | D. | v (C)═1.0mol/(L•min) |
2.设NA为阿伏加德罗常数,下列说法中,正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | B. | 16gCH4所含原子数目为NA | ||
| C. | 17gNH3所含电子数目为10NA | D. | 18g水所含分子数目为NA |