题目内容
【题目】(1)从氧化还原的角度分析水在下列化学反应中只做还原剂的是_______________
A电解水 B钠和水的反应(2Na+2H2O===2NaOH+H2↑)
C氟气和水反应(2F2+2H2O===4HF+O2) D氯气和水反应(Cl2+H2O===HCl+HClO):
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是________;若反应方程式中转移了0.4 mol电子,则氧化产物的质量是_____ g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-,这个事实说明Fe2+、Cl-、Br—三种粒子还原性由强到弱的排列顺序为:__________________。
【答案】CNO6.4gFe2+>Br—>Cl-、
【解析】试题分析:(1)反应中水中元素化合价只升高时,水只做还原剂;(2) 硝酸的氧化性大于S,所以该反应中硝酸做氧化剂,反应中得电子化合价降低,氯化氢是还原剂,反应中失电子化合价升高,方程式3H2S+2HNO3=3S+2NO+4H2O,结合化合价变化计算解答;同种氧化剂先与还原性强的物质反应;
解析:(1)
电解水时,水中氢元素化合价降低、氧元素化合价升高,所以水既是氧化剂又是还原剂 ; 钠和水的反应2Na+2H2O===2NaOH+H2↑,水中氢元素化合价降低,水做氧化剂;
氟气和水反应2F2+2H2O===4HF+O2,水中氧元素化合价升高 ,水做还原剂;氯气和水反应Cl2+H2O===HCl+HClO,水中元素化合价不变,水既不是氧化剂又不是还原剂 ;(2)硝酸的氧化性大于S,所以硝酸做氧化剂,S做氧化产物,反应方程式为3H2S+2HNO3=3S+2NO+4H2O,反应中N元素化合价降低,所以NO是还原产物;氧化产物是S,电子转移的方向和数目为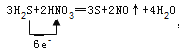 ,转移6 mol电子,生成3S,所以转移了0.4 mol电子,生成0.2mol S,质量为6.4 g;(3)还原剂的氧化性大于还原产物的还原性;根据氧化还原反应的先后规律,同种氧化剂先与还原性强的物质反应;将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,Fe2+先与Cl2反应,说明Fe2+还原性大于Br—,在2Fe2++Cl2===2Fe3++2Cl-反应中Fe2+是还原剂,Cl-是还原产物,所以还原性Fe2+还原性大于Cl-,三种粒子还原性由强到弱的排列顺序为Fe2+>Br—>Cl-。
,转移6 mol电子,生成3S,所以转移了0.4 mol电子,生成0.2mol S,质量为6.4 g;(3)还原剂的氧化性大于还原产物的还原性;根据氧化还原反应的先后规律,同种氧化剂先与还原性强的物质反应;将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,Fe2+先与Cl2反应,说明Fe2+还原性大于Br—,在2Fe2++Cl2===2Fe3++2Cl-反应中Fe2+是还原剂,Cl-是还原产物,所以还原性Fe2+还原性大于Cl-,三种粒子还原性由强到弱的排列顺序为Fe2+>Br—>Cl-。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案