题目内容
4.下列说法正确的是( )| A. | 常温下,pH=1的溶液中还可以大量存在:K+、MnO4-、SO42-、CH3CHO | |
| B. | 含有较多Fe3+的溶液中还可以大量存在:Na+、SO42-、SCN-、CO32- | |
| C. | 碳酸氢钙溶液与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
分析 A.pH=1的溶液呈酸性,离子发生氧化还原反应;
B.与Fe3+反应的离子不能大量共存;
C.碳酸氢钙溶液与过量的NaOH溶液反应生成碳酸钙沉淀和CO32-;
D.向FeBr2溶液中通入过量氯气,Fe2+、Br-全部被氧化,且比值为1:2.
解答 解:A.pH=1的溶液呈酸性,MnO4-、CH3CHO发生氧化还原反应,不能大量共存,故A错误;
B.SCN-与Fe3+发生络合反应,CO32-与Fe3+发生互促水解反应,不能大量共存,故B错误;
C.碳酸氢钙溶液与过量的NaOH溶液反应生成碳酸钙沉淀和CO32-,反应的离子方程式为Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-,故C正确;
D.向FeBr2溶液中通入过量氯气,Fe2+、Br-全部被氧化,且比值为1:2,应为2Fe2++4Br-+3Cl2═2Fe3++Br2+6Cl-,故D错误.
故选C.
点评 本题考查较为综合,涉及离子共存与离子方程式的书写,为高频考点,侧重于学生的分析能力,注意把握离子的性质以及反应类型的判断,难度不大.

练习册系列答案
相关题目
14.下列各组X与Y原子所形成的极性共价键X-Y中,极性最强的是( )
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p3 Y:2s22p4 | ||
| C. | X:3s23p1 Y:2s22p5 | D. | X:2s22p3 Y:1s1 |
19.下列说法正确的是( )
| A. | 乙烯和聚氯乙烯均能使溴水褪色,发生加成反应 | |
| B. | 丁烷(C4H10)和二氯甲烷都存在同分异构体 | |
| C. | “地沟油”的主要成分是油脂,其成分与矿物油不同 | |
| D. | 淀粉,蛋白质,蔗糖都是能发生水解的高分子化合物 |
16.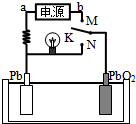 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )| A. | K与N相接时,能量由化学能转化为电能 | |
| B. | K与N相接时,H+向负极区迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
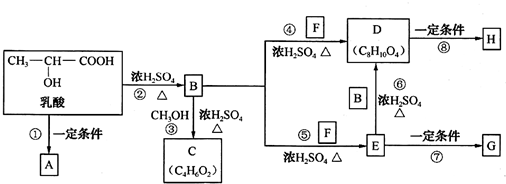
 .
.

 .
. .
. .
.

 .
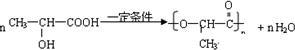
.

 +2H2O.
+2H2O.