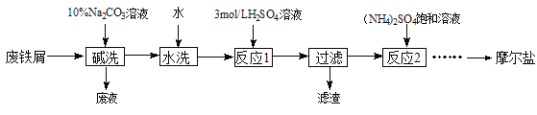
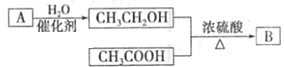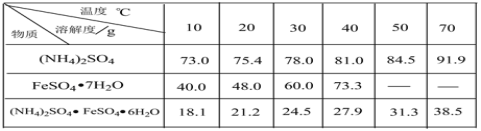题目内容
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO![]() 、CO
、CO![]() 、SO
、SO![]() 、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
、Cl中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
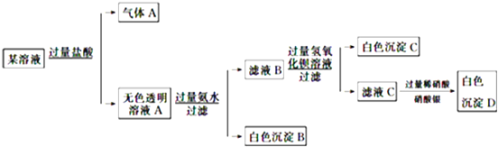
A. 原溶液中一定只存在![]() 、
、![]() 、
、![]() 、Cl-四种离子
、Cl-四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++3OH===Al(OH)3↓
【答案】C
【解析】
某溶液加入过量的盐酸后产生气体,说明有碳酸根离子,则钡离子铁离子和铜离子都不存在,溶液A加入过量的氨水产生白色沉淀,则说明原溶液中有偏铝酸根离子,沉淀为氢氧化铝,滤液B加入过量的氢氧化钡产生白色沉淀,说明原溶液中有硫酸根离子,滤液C加入过量的稀硝酸和硝酸银,产生白色沉淀,因为最初加入盐酸,不能说明原溶液中是否有氯离子。
A.通过分析可知,原溶液中一定有偏铝酸根离子,碳酸根离子,硫酸根离子,钠离子,不能确定氯离子,故错误;
B.气体A的化学式是CO2,其电子式为![]() ,故错误;
,故错误;
C.通过分析可知原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+,故正确;
D.生成沉淀B的离子方程式为:Al3++3NH3H2O===Al(OH)3↓+3NH4+,故错误。
正确选项C。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ![]() 探究1:验证同周期X、Y、Z三种元素金属性递变规律
探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Y剧烈 |
2、各取1.0g的金属Z和金属Y形状相同,分别加入到5mL 1.0mol/L盐酸中。 | 金属Y与盐酸反应比金属Z剧烈 |
(1)通过实验验证三种元素金属性由强到弱是_______________________,
(2)下列判断正确的是______
A.原子序数:![]()
![]() 原子的最外层电子数
原子的最外层电子数![]()
C.原子半径:X>Y>Z D. Z的最高价氧化物对应水化物的碱性最强
Ⅱ![]() 探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
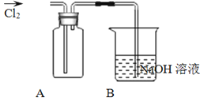
![]() 装置A中盛放的试剂是______
装置A中盛放的试剂是______![]() 填选项
填选项![]()
A.![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
B中反应的离子方程式是__________________________________________________。
![]() 下列不能用于验证氯元素比硫元素非金属性强的依据为______
下列不能用于验证氯元素比硫元素非金属性强的依据为______![]() 填选项
填选项![]()
A.HCl酸性比![]() 强 B.HClO氧化性比
强 B.HClO氧化性比![]() 强
强
C.HClO3酸性比![]() 强 D.铁与
强 D.铁与![]() 反应生成
反应生成![]() ,而硫与铁反应生成FeS
,而硫与铁反应生成FeS
![]() 若要验证非金属性:
若要验证非金属性:![]() ,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液______的现象,即可证明。用原子结构理论解释非金属性
,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液______的现象,即可证明。用原子结构理论解释非金属性![]() 的原因:同主族元素从上到下,____________________。
的原因:同主族元素从上到下,____________________。