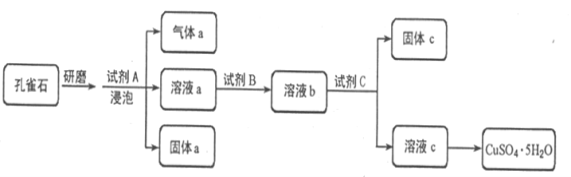
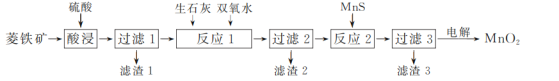
题目内容
【题目】实验室制备硝基苯的反应装置如图所示,步骤之一是将仪器a中浓硝酸和浓硫酸形成的混酸加入到装有苯的三颈烧瓶中,则下列叙述不正确的是( )

A.仪器a的名称是恒压滴液漏斗
B.长玻璃导管可以起到冷凝回流的作用
C.配制混酸时应在烧杯中先加入浓硫酸
D.分离出硝基苯的主要操作是分液和蒸馏
【答案】C
【解析】
A.根据仪器装置图可知,仪器a是恒压滴液漏斗,故A不符合题意;
B.加热条件下,苯、浓硝酸均易挥发,因此长玻璃导管可起到平衡装置内外气压以及冷凝回流的作用,故B不符合题意;
C.浓硫酸密度较大,且溶解过程中放出大量热,因此不能先加入浓硫酸,应在浓硝酸中加入浓硫酸,冷却后滴入苯,其目的是:一方面两酸混合产生大量的热,使混合酸的温度升高,一部分浓硝酸将分解;另一方面,苯的沸点比较低,大量的苯将蒸发掉,影响硝基苯的产率,故C符合题意;
D.苯和硝基苯不易溶于水中,因此产品可先进行分液,分离出苯和硝基苯的有机层,然后利用蒸馏有机物分离出硝基苯,故D不符合题意;
故答案为:C。

 名校课堂系列答案
名校课堂系列答案【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为______ (填“放热”,“吸热”,“无法确定”)反应。
②下列措施能用勒夏特列原理解释是__________。(填序号)
A.增大压强有利于合成氨
B.使用合适的催化剂有利于快速生成氨
C.生产中需要升高温度至500C左右
D.需要使用过量的N2,提高H2转化率
(2)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl),则一水合氨的电离平衡常数Kb=_______________。(用ab表示)
(3)原料气H2可通过反应 CH4(g) + H2O (g)![]() CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线所表示压强的关系是:P1__________P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__________。(填“增大”,“减小”,“不变”)
(4)原料气H2还可通过反应CO(g) + H2O(g) ![]() CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,该温度下反应的平衡常数K值为______________。
②保持温度仍为T ℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的_____(填序号)。
A.容器内压强不随时间改变
B.混合气体的密度不随时间改变
C.单位时间内生成a mol CO2的同时消耗a mol H2
D.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1 : 16 : 6 : 6
【题目】实验小组同学探究稀H2SO4对溶液中的I—被O2 氧化的影响因素。
(1)为了探究c(H+)对反应速率的影响,进行实验:
10mL 1mol· L-1 KI溶液5滴淀粉溶液 | 序号 | 加入试剂 | 变色时间 |
Ⅰ | 10mL蒸馏水 | 长时间放置,未见明显变化 | |
Ⅱ | 10mL 0.1mol· L-1H2SO4溶液 | 放置3min后,溶液变蓝 | |
Ⅲ | 10mL 0.2mol· L-1H2SO4溶液 | 放置1min后,溶液变蓝 | |
Ⅳ | 10mL 0.1mol· L-1K2SO4溶液 | 长时间放置,未见明显变化 |
① 写出实验Ⅱ发生反应的离子方程式 ______。
② 实验Ⅰ~Ⅲ所得结论:_______。
③ 增大实验Ⅱ反应速率还可以采取的措施 ______。
④ 实验Ⅳ的作用是______。
(2)为探究c(H+)除了对反应速率影响外,是否还有其他影响,提出假设:
ⅰ. 增大c(H+),增强O2的氧化性;
ⅱ. 增大c(H+),_______。
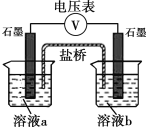
小组同学利用下图装置设计实验方案,对假设进行验证。
| 序号 | 溶液a | 溶液b | 现象 |
Ⅴ | 10mL 1mol· L-1 KI溶液 10mL H2O | 10mL 0.1mol·L-1K2SO4溶液 10mLH2O | 指针未见偏转 | |
Ⅵ | 10mL 1mol· L-1 KI溶液 10mL H2O | 10mL 0.1mol·L-1K2SO4溶液 1mL 0.2mol·L-1H2SO4溶液 9mL H2O | 指针 偏转 | |
Ⅶ | X | 10mL 0.1mol·L-1K2SO4溶液 10mL 0.2mol·L-1H2SO4溶液 | Y | |
Ⅷ | Z | 10mL 0.1mol·L-1K2SO4溶液 10mLH2O | 指针未见偏转 |
通过实验证实假设ⅰ合理,将表中空白处的试剂或现象补充完整。
X __________;Y _________;Z __________。
【题目】白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
i. 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
ii. 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
iii. 取20.00 mL待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
iv. 重复滴定实验3次并记录数据。
ⅴ.计算醋酸总酸度。
回答下列问题:
(1)实验i中量取20.00 mL白醋所用的仪器是______(填字母)。
|
|
|
|
a | b | c | D |
(2)若实验ii中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____(填“偏大”、“偏小”或“不变”)。
(3)实验iii中判断滴定终点的现象是_______。
(4)实验数据如下表,则该白醋的总酸度为_______mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |