题目内容
【题目】我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R 代表)。回答下列问题:
(1)基态N 原子中,核外电子占据的最高能层的符号是______________,占据该能层电子的电子云轮廓图形状为_______________________________。
(2)N 和O 两种元素第一电离能大小关系是N__________( 填“ >”“ <” 或“ =” )O,其原因是____________;N 和O两种元素电负性大小关系是N_______(填“ >”“ <” 或“=” )O。
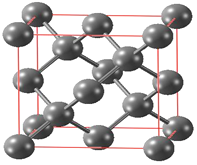
(3)经X-射线衍射测得化合物R 的晶体结构,其局部结构如下图所示。

①组成化合物R 的两种阳离子中σ键的个数之比为_________;其中四核阳离子的立体构型为___________,其中心原子的杂化轨道类型是_______________________。
②分子中的大π键可用符号![]() 表示,其中m 代表参与形成的大π键原子数,n 代表参与形成的大π键电子数,如苯分了中的大π键可表示为
表示,其中m 代表参与形成的大π键原子数,n 代表参与形成的大π键电子数,如苯分了中的大π键可表示为![]() 。则N5-中的大π键应表示为___________________。
。则N5-中的大π键应表示为___________________。
③氢键通常用X-H…···Y 表示,请表示出上图中的所有氧键:_________________。
④R的立方晶胞参数为a nm,晶胞中含有Y个(N5)6(H3O)3(NH4)4Cl 单元,如果(N5)6(H3O)3(NH4)4Cl的相对分子质量用M 表示,阿伏加德罗常数的值为NA,则R 晶体的密度为________g·cm-3。
【答案】 L 球形和哑铃形 > N原子2P能级处于半充满状态,相对稳定,失去一个电子吸收的能量较大 < 3:4(或4:3) 三角锥形 sp3 ![]() N-H···N、O-H····N、N-H···Cl
N-H···N、O-H····N、N-H···Cl 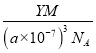
【解析】(1)基态N原子的电子排布式为1s22s22p3,核外电子占据的最高能层的符号是L,L能层中s能级电子云轮廓图形状为球形、p能级电子云轮廓图形状为哑铃形,故答案为:L;球形和哑铃形;
(2)N的2p为半充满结构,较为稳定,第一电离能:N>O;N的非金属性比O小,非金属性越强,电负性数值越大,电负性:N<O,故答案为:>; N原子2P能级处于半充满状态,相对稳定,失去一个电子吸收的能量较大;<;
(3)①根据图(b),阳离子为H3O+和NH4+,NH4+中心原子N含有4个σ键,H3O+中心原子是O,含有3σ键,σ键的个数之比为3:4(或4:3);其中四核阳离子为H3O+,H3O+中心原子是O,含有3σ键,孤电子对数为![]() =1,空间构型为正四面体,价层电子对数为4,为sp3杂化,空间构型为三角锥形,故答案为:;三角锥形;sp3;
=1,空间构型为正四面体,价层电子对数为4,为sp3杂化,空间构型为三角锥形,故答案为:;三角锥形;sp3;
②根据图(b)N5-中键总数为5个,根据信息,N5-有6个电子可形成大π键,可用符号Π56表示,故答案为:Π56;
③根据图示,其中的氢键可表示为O-H…N、N-H…N,以及N-H···Cl,故答案为: O-H…N、N-H…N、N-H···Cl;
④R的立方晶胞参数为anm,晶胞中含有Y个(N5)6(H3O)3(NH4)4Cl单元,如果(N5)6(H3O)3(NH4)4Cl的相对分子质量用M表示,阿伏加德罗常数的值为NA,则R晶体的密度=![]() =
=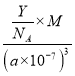 =
=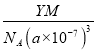 g·cm-3,故答案为:
g·cm-3,故答案为: 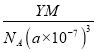 。
。