题目内容
【题目】CN-可以造成水体污染,某小组采用如下方法对污水进行处理。
Ⅰ![]() 双氧水氧化法除NaCN。
双氧水氧化法除NaCN。
(1)NaCN的电子式为____________________________。
(2)碱性条件下加入双氧水除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为________________。
Ⅱ.CN-和Cr2O72-联合废水处理法。
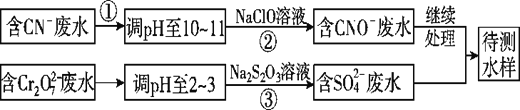
(3)②中反应后无气体放出,该反应的离子方程式为_____________________。
(4)步骤③中,每处理0.4mol Cr2O72-,至少消耗Na2S2O3________mol。
【答案】![]() 5H2O2+2CN-+2OH-=N2↑+2CO32-+6H2OCN-+ClO-=CNO-+Cl-0.3mol
5H2O2+2CN-+2OH-=N2↑+2CO32-+6H2OCN-+ClO-=CNO-+Cl-0.3mol
【解析】
(1)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键,电子式为![]() ;
;
(2)碱性条件下加入双氧水除CN-,可得到纯碱和一种无色无味的无毒气体,碱性气体为氨气,氰化钠溶液的CN-被双氧水氧化为CO32-,同时放出NH3,反应的化学方程式为5H2O2+2CN-+2OH-=N2↑+2CO32-+6H2O;
(3)步骤②中无气体放出,CN-被ClO-氧化为CNO-,又因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为CN-+ClO-=CNO-+Cl-;
(4)步骤③的离子反应为3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O,因此每处理0.4mol Cr2O72-,消耗Na2S2O3的物质的量是0.3mol。

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目