题目内容
【题目】(1)某固体物质可能含有氯化钾、硫酸铜、氢氧化钠、硝酸镁,硫酸钠中的一种或几种,为鉴定它们,做如下实验:
①将该固体物质全部溶解于水中,得到无色溶液a。
②取少量a溶液于试管中,向其中滴加少量硫酸铁溶液,产生红褐色沉淀
③另取少量a溶液于试管中,向其中滴加少量的硝酸钡溶液,产生白色沉淀
步骤③中发生反应的化学方程式__________________________。据此推断,该固体物质中一定含有(以下写化学式,下同)______________,一定不含有________________,可能含有_____。
(2)下图是初中化学常见六种物质之间的关系图(物质是溶液的只考虑溶质)。图中用“—”表示两种物质之间能发生化学反应,用“→”表示一种物质可以转化为另一种物质(部分反应物或生成物及反应条件已略去)。
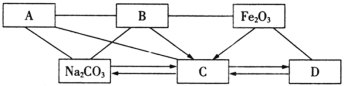
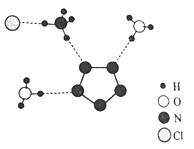
A是一种碱,其中阳离子是人体骨骼中的主要成分,B是胃酸的主要成分。C、D中所含元素种类相同。
①请分别写出A、B、C、D物质的化学式(或溶质的化学式):
A.___________ B.___________ C.___________ D.___________;
②写出Fe2O3反应生成C物质的化学方程式___________________________(写一个);
③写出Fe2O3与足量B反应的实验现象_______________________________________。
【答案】Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3NaOH、Na2SO4CuSO4、Mg(NO3)2KClA:Ca(OH)2B:HClC:CO2D:CO3CO+Fe2O3![]() 2Fe+3CO2(或3C+2Fe2O3
2Fe+3CO2(或3C+2Fe2O3![]() 4Fe+3CO2↑)红棕色固体逐渐(减少至)消失,溶液(由无色)变为黄色
4Fe+3CO2↑)红棕色固体逐渐(减少至)消失,溶液(由无色)变为黄色
【解析】
(1)①将该固体物质全部溶解于水中,得到无色溶液a,由于硫酸铜溶液是蓝色的,故一定不会含有硫酸铜,氢氧化钠能与硝酸镁反应产生白色沉淀,故氢氧化钠和硝酸镁不会同时存在;②取少量a溶液于试管中,向其中滴加少量硫酸铁溶液,产生红褐色沉淀,说明含有氢氧化钠,故一定不会含有硝酸镁;③另取少量a溶液于试管中,向其中滴加少量的硝酸钡溶液,产生白色沉淀,说明含有硫酸钠,据此解答。(2)根据题意可知,A中含有人体中含量最多的金属元素,应是钙元素,A是一种碱,所以A为氢氧化钙;根据C、D中所含元素种类相同,二者之间可以相互转化,D能与氧化铁反应,碳酸钠可以转化为C,C为二氧化碳,则D为一氧化碳,B是胃酸的主要成分,B应为盐酸。
(1)①将该固体物质全部溶解于水中,得到无色溶液a,由于硫酸铜溶液是蓝色的,故一定不会含有硫酸铜,氢氧化钠能与硝酸镁反应产生白色沉淀,故氢氧化钠和硝酸镁不会同时存在;②取少量a溶液于试管中,向其中滴加少量硫酸铁溶液,产生红褐色沉淀,说明含有氢氧化钠,故一定不会含有硝酸镁;③另取少量a溶液于试管中,向其中滴加少量的硝酸钡溶液,产生白色沉淀,说明含有硫酸钠,氯化钾不能确定是否存在;该固体中一定存在NaOH、Na2SO4,一定不存在CuSO4、Mg(NO3)2,可能含有KCl;步骤③中硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,方程式是 Na2SO4+Ba(NO3)2═BaSO4↓+2NaNO3。(2)①由上述分析可知,A、B、C、D物质的化学式分别为:Ca(OH)2、HCl、CO2、CO。
②由上述分析可知,一氧化碳还原氧化铁生成了二氧化碳,反应的化学方程式是:Fe2O3+3CO![]() 2Fe+3CO2;③由于Fe2O3与足量盐酸反应生成了氯化铁和水,所以,反应的实验现象是:红棕色固体逐渐消失,溶液由无色逐渐变为黄色。
2Fe+3CO2;③由于Fe2O3与足量盐酸反应生成了氯化铁和水,所以,反应的实验现象是:红棕色固体逐渐消失,溶液由无色逐渐变为黄色。

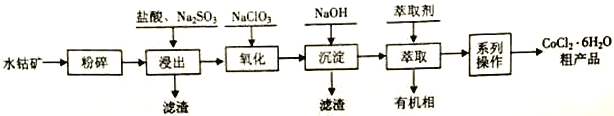
【题目】水钴矿的主要成分为Co2O3,还含SiO2及少量Al2O3、Fe2O3、 CuO、MnO2等。一种利用水钴矿制取CoCl2·6H2O 的工艺流程如下:
已知: ①CoCl2·6H2O受热易失去结晶水。
②25 ℃时,设定溶液中某金属离子初始浓度为0.1 molL-1,部分沉淀的参考数据如下表(“沉淀完全”指溶液中该离子浓度≤1.0×10-5molL-1):
沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.4 | 1.5 | 6.3 | 7.0 | 4.7 | 8.1 |
沉淀完全时pH | 4.7 | 2.8 | 8.3 | 9.0 | 6.7 | 10.1 |
回答下列问题
(1)计算25℃时Co(OH)2的Ksp =_______________。
(2)浸出工序中加入一定量的Na2SO3还原Co2O3、MnO2等,Co2O3发生反应的离子方程式为_______________________________。
(3)氧化工序要控制NaClO3用量,若不慎加入过量NaClO3,可能生成的有毒气体是______________;氧化工序主要反应的离子方程式为_______________________________。
(4)已知温度对铜、钴、铁的浸出率的影响如左下图,萃取剂A、B中pH对钴、锰离子萃取率的影响如右下图:
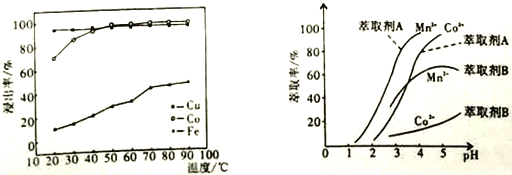
①浸出温度控制在50-60℃的原因是_________________________。
②应选择萃取剂_________________________(填“A”或“B”)。
(5)“系列操作”依次是____________、______________和过滤等;制得的CoCl2·6H2O需减压烘干的原因是_________________________。
【题目】分类、类比是学习化学常用的方法。
(1)初中化学有许多实验,若按照实验主要目的可将实验分为:探究化学反应前后物质的质量关系、探究物质的性质、探究物质的含量等。据此应将下列实验中的D与________(填“A”或“B”或“C”)归为一类,依据是_______________________________________。
|
|
|
|
A | B | C | D |
(2)实验室现有氯酸钾、稀盐酸、二氧化锰、大理石、火柴、药匙、镊子及以下仪器:

①若补充仪器____________和___________(填名称),并利用上述部分仪器和药品可制取一种气体,则发生反应的化学方程式为____________________________________。
②制取该气体时,需先检查装置的气密性:连接好仪器。将导管一端浸入水中,用手紧握容器外壁,使容器内温度_________,压强变_____,观察到水中导管口有___________时,说明装置不漏气。
(3)许多物质的命名与元素的化合价高低有关,如锰酸钾、高锰酸钾,其中锰元素的化合价分别为+6、+7。氯元素常见的化合价有+7、+5、+1、-1等,由此推测钠元素、氯元素和+7价氯元素三种元素组成的化合物的名称为_____________,化学式为_____________。
【题目】煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表;
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________________________。增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______(填“提高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(2在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
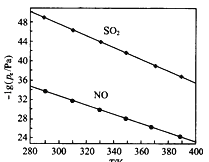
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的有点是_______。
②已知下列反应:
SO2(g)+2OH(aq)==SO32(aq)+H2O(l)ΔH1
ClO(aq)+SO32(aq)===SO42(aq)+Cl(aq)ΔH2
CaSO4(s)==Ca2+(aq)+SO42(aq)ΔH3
则反应SO2(g)+Ca2+(aq)+ ClO(aq)+2OH(aq)===CaSO4(s)+H2O(l)+Cl(aq)的ΔH=______。