题目内容
8. 研究金属铁及其化合物的性质有重要意义.
研究金属铁及其化合物的性质有重要意义.(1)硫酸工业生产中,多采用煅烧黄铁矿(主要成分是FeS2,Fe为+2价)生产SO2,同时得到氧化铁.反应中被氧化的元素为Fe、S,反应中转移2.2mol电子,理论上可生成8.96L SO2(标准状况下).
(2)印刷线路板腐蚀废液中含有FeCl3、FeCl2和CuCl2.欲从废液中回收铜,并重新获得FeCl3溶液.回收铜时,需要用到的试剂为铁粉、稀盐酸,向回收铜后的溶液通入C12,充分反应后就可获得FeCl3溶液,写出通入Cl2时发生反应的离子方程式2Fe2+Cl2=2Fe3++2Cl-.
(3)以Fe和石墨作电极,电解饱和食盐水制Fe(OH)2,写出电解的总反应式Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2↑+H2↓.
(4)钢铁露置在潮湿空气中主要发生电化学腐蚀,如图是海水对铁闸不同部位腐蚀情况的剖面示意图.下列判断正确的是bd(填写序号).
a.发生的电化学腐蚀主要是析氢腐蚀
b.发生电化学腐蚀的负极反应为:Fe-2e-=Fe2+
c.图中①、②、③三个区域,生成铁锈最多的是③
d.图中①、②、③三个区域,生成铁锈最多的是②
铁器深埋地下,也会发生严重的电化学腐蚀,原因是一种称为硫酸盐还原菌的细菌,能提供正极反应的催化剂,将土壤中的SO42-还原为S2-,试写出该电化学腐蚀的正极反应式SO42-+4H2O+8e-=S2-+8OH-.
分析 (1)发生4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,Fe、S元素的化合价升高;该反应中生成8molSO2转移转移44mol电子;
(2)从废液中回收铜,加Fe置换出Cu;通入Cl2时,与亚铁离子发生氧化还原反应;
(3)以Fe和石墨作电极,电解饱和食盐水制Fe(OH)2,则Fe为阳极失去电子,阴极上氢离子得到电子;
(4)由图可知,海水中金属发生吸氧腐蚀,Fe失去电子,①处干燥,③处氧气少,②处满足吸氧腐蚀的条件;土壤中的SO42-还原为S2-,可知得到电子,以此书写电极反应式.
解答 解:(1)发生4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,Fe、S元素的化合价升高,则Fe、S被氧化;该反应中生成8molSO2转移转移44mol电子,则反应中转移2.2mol电子,理论上可生成SO2为2.2×$\frac{8}{44}$×22.4L/mol=8.96L,故答案为:Fe、S;8.96;
(2)从废液中回收铜,加Fe置换出Cu,再加盐酸除去过量的Fe,过滤即可;通入Cl2时,与亚铁离子发生氧化还原反应,离子反应为2Fe2+Cl2=2Fe3++2Cl-,
故答案为:铁粉、稀盐酸;2Fe2+Cl2=2Fe3++2Cl-;
(3)以Fe和石墨作电极,电解饱和食盐水制Fe(OH)2,则Fe为阳极失去电子,阴极上氢离子得到电子,则电解的总反应式为Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2↑+H2↓,
故答案为:Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2↑+H2↓;
(4)a.发生的电化学腐蚀主要是吸氧腐蚀,故a错误;
b.Fe为负极失去电子,则发生电化学腐蚀的负极反应为:Fe-2e-=Fe2+,故b正确;
c.图中①、②、③三个区域,①处干燥,③处氧气少,②处满足吸氧腐蚀的条件,生成铁锈最多的是②,故c错误;
d.图中①、②、③三个区域,②处满足吸氧腐蚀的条件,生成铁锈最多的是②,故d正确;
土壤中的SO42-还原为S2-,可知得到电子,则该电极反应式为SO42-+4H2O+8e-=S2-+8OH-,
故答案为:bd;SO42-+4H2O+8e-=S2-+8OH-.
点评 本题考查较综合,涉及氧化还原反应的计算、电解原理及应用、原电池等,注重高频考点的考查,为2015年高三模拟题,把握物反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案| A. | 0.5mol/L K2SO4溶液所含K+数目为NA | |
| B. | 标况下22.4L苯所含分子数目为NA | |
| C. | 56gFe与足量盐酸完全反应时,失去电子数目为NA | |
| D. | 常温常压下,16gO2和O3的混合气体所含原子数目为NA |
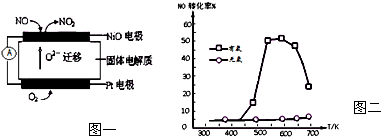
(1)连续自动监测氮氧化物(NOx)的仪器--动态库仑仪已获得实际应用.它的工作原理如下图一所示.NiO电极上NO发生的电极反应式为NO+O2--2e-=NO2.
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术.压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,相关反应为:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1<0
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2<0
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3
则△H3=$\frac{△{H}_{1}+△{H}_{2}}{2}$.(用△H1和△H2表示)
(3)实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应③,测得在不同温度、不同投料比时,NO2的平衡转化率如下表:
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
A.增加催化剂的表面积B.改用高效催化剂 C.降低温度
D.增大压强E.分离出H2O(g) F.减小[n(NO2)/n(CH4)]
②400K时,将投料比为1的NO2和CH4的混合气体共0.40mol,充入容积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数.(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出0min~15min内,容器中CO2物质的量浓度c随时间变化的曲线图.
(4)SNCR是一种新型的烟气脱氮环保技术.在有氧条件下,其脱氮原理是:NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=-1627.2kJ•mol-1.NO和NH3在Ag2O催化剂表面的反应随温度的变化曲线如右图所示.图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是(回答两条):脱氮反应是放热反应,达到平衡后升高温度,平衡逆向移动;温度升高发生了副反应:4NH3+5O2═4NO+6H2O.
| A. | 乙烷与氯气光照反应 | B. | 乙烯与氯气加成反应 | ||
| C. | 乙烯与氢气、氯气混合气体反应 | D. | 乙烯与氯化氢加成反应 |
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | NaHCO3与澄清石灰水反应 | ||
| C. | Ca(HCO3)2与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
 氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化.
氮及其化合物的转化是资源利用和环境保护的重要研究课题,下面是氮的氧化物的几种不同情况下的转化. $→_{△}^{-H_{2}O}$CH3CH=CHCHO
$→_{△}^{-H_{2}O}$CH3CH=CHCHO +CO$→_{△}^{AlCl_{3},HCl}$
+CO$→_{△}^{AlCl_{3},HCl}$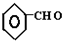

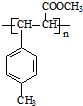 .
. .
.