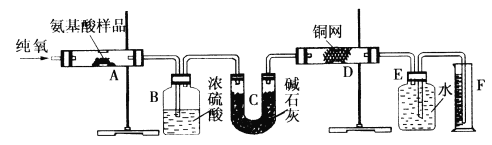
题目内容
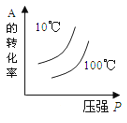
【题目】下列图象中的曲线![]() 纵坐标为沉淀或气体的量,横坐标为加入物质的量
纵坐标为沉淀或气体的量,横坐标为加入物质的量![]() ,其中错误的是
,其中错误的是
A.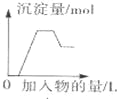 表示向含
表示向含![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中滴加NaOH溶液产生沉淀的关系曲线
的溶液中滴加NaOH溶液产生沉淀的关系曲线
B. 表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C.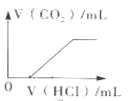 表示向NaOH和
表示向NaOH和![]() 的混合液中滴加盐酸产生
的混合液中滴加盐酸产生![]() 气体的关系曲线
气体的关系曲线
D.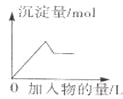 表示向氯化铝和氯化镁溶液中滴加
表示向氯化铝和氯化镁溶液中滴加![]() 溶液产生沉淀量的关系曲线
溶液产生沉淀量的关系曲线
【答案】C
【解析】
A.![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中
的溶液中![]() 最易与
最易与![]() 反应,所以开始无沉淀,其次为
反应,所以开始无沉淀,其次为![]() ,反应后生成水、氢氧化铝,出现沉淀,
,反应后生成水、氢氧化铝,出现沉淀,![]() 和
和![]() 反应生成氢氧化镁,沉淀达最大量,继续滴加,
反应生成氢氧化镁,沉淀达最大量,继续滴加,![]() 和
和![]() 反应生成一水合氨,沉淀量不变,继续滴加,氢氧化铝溶解,
反应生成一水合氨,沉淀量不变,继续滴加,氢氧化铝溶解,![]() ,故A正确;
,故A正确;
B.石灰水中通入二氧化碳,先发生![]() ,生成沉淀,后发生
,生成沉淀,后发生![]() ,故先产生沉淀,后沉淀溶解,前后两部分二氧化碳的物质的量为1:1,故B正确;
,故先产生沉淀,后沉淀溶解,前后两部分二氧化碳的物质的量为1:1,故B正确;
C.向NaOH和![]() 的混合液中滴加盐酸,盐酸先和氢氧化钠反应,NaOH+
的混合液中滴加盐酸,盐酸先和氢氧化钠反应,NaOH+![]() 开始没有气体,然后再与碳酸钠反应,
开始没有气体,然后再与碳酸钠反应,![]() ,
,![]() ,产生
,产生![]() 气体,开始未产生气体消耗的盐酸应比产生气体消耗的盐酸多,图象错误,故C错误;
气体,开始未产生气体消耗的盐酸应比产生气体消耗的盐酸多,图象错误,故C错误;
D.向氯化铝和氯化镁溶液中加入![]() 溶液,刚开始反生反应Mg2++2OH-=Mg(OH)2,
溶液,刚开始反生反应Mg2++2OH-=Mg(OH)2,![]() ,继续滴加,则发生
,继续滴加,则发生![]() ,故D正确;
,故D正确;
答案选C。

练习册系列答案
相关题目