题目内容
【题目】钙及其化合物在工业上、建筑工程上和医药上用途很大。回答下列问题
(1)基态Ca原子M能层有_____个运动状态不同的电子,Ca的第一电离能__________(填“大于”或“小于”)Ga。
(2)Mn和Ca属于同一周期,且核外最外层电子构型相同,但金属Mn的熔点沸点等都比金属Ca高,原因是____________________。
(3)氯气与熟石灰反应制漂白粉时会生成副产物Ca(ClO3)2,Ca(ClO3)2中的阴离子空间构型是__________、中心原子的杂化形式为___________。
(4)碳酸盐的热分解示意图如图所示

热分解温度:CaCO3_______ (填“高于”或“低于”)SrCO3,原因是_____________________________。从价键轨道看,CO2分子内的化学键类型有__________。
(5)萤石是唯一一种可以提炼大量氟元素的矿物,晶胞如图所示。Ca2+的配位数为__________,萤石的一个晶胞的离子数为__________,已知晶胞参数为0.545nm,阿伏加德罗常数的值为NA,则萤石的密度为__________g·cm-3(列出计算式)。

【答案】8 大于 Mn原子半径较小且价电子数较多,金属键较强 三角锥形 sp3 低于 r(Ca2+)<r(Sr2+),CaO晶格能大于SrO晶格能,故CaCO3更易分解为CaO σ键,π键 8 12 ![]()
【解析】
(1)原子核外电子的运动状态是由能层、能级(电子云)、电子云伸展方向、电子自旋决定的,据此解答。
(2) Mn和Ca属于同一周期,从原子半径和价电子数影响金属键强弱角度分析。
(3)分析阴离子ClO3-的中心氯原子的孤电子对数和σ键数,再根据价层电子对互斥理论确定该阴离子的空间构型和中心原子的杂化轨道类型。
(4)根据碳酸盐的热分解示意图可知, CaCO3热分解生成CaO,SrCO3热分解生成SrO,CaO和SrO都是离子晶体,离子晶体的晶格能越大,离子晶体越稳定,生成该晶体的反应越容易发生。
(5)根据萤石晶胞示意图中黑球和白球实际占有的个数,结合萤石的化学式(CaF2)中粒子个数比确定黑球、白球分别代表的粒子种类。在分析Ca2+的配位数时,可将萤石晶胞分割为8个小立方体,利用晶胞的“无隙并置”的特点,确定与1个Ca2+距离最近且相等的F-的个数。一个粒子(Ca2或F-)的质量=![]() ,由于晶胞实际占有4个Ca2+和8个F-,故而确定晶胞质量,再根据公式ρ=
,由于晶胞实际占有4个Ca2+和8个F-,故而确定晶胞质量,再根据公式ρ=![]() 计算该晶体的密度。
计算该晶体的密度。
(1)原子核外电子的运动状态是由能层、能级(电子云)、电子云伸展方向、电子自旋决定的。基态Ca原子核外电子排布式为1s22s22p63s23p64s2,所以M能层上有8个运动状态不同的电子。由于Ca原子的价层电子排布为4s2,已达全充满状态,比较稳定;而Ga原子价层电子排布为4s24p1,不太稳定,所以Ca的第一电离能大于Ga的第一电离能。
(2) Mn和Ca属于同一周期,同周期从左至右原子半径逐渐减小;Mn原子价层电子排布为3d54s2,Ca原子价层电子排布为4s2,价电子数Mn比Ca多,原子半径越小,价电子数越多,金属键越强。所以,金属Mn的熔点沸点等都比金属Ca高的原因是:Mn原子半径较小且价电子数较多,金属键较强。
(3) Ca(ClO3)2中的阴离子化学式为ClO3-,中心原子氯的孤电子对数=![]() (7+1-3×2)=1,σ键数=3,中心原子氯的价层电子对数=1+3=4,根据价层电子对互斥理论,ClO3-的空间构型是三角锥形,中心原子氯的杂化形式为sp3。
(7+1-3×2)=1,σ键数=3,中心原子氯的价层电子对数=1+3=4,根据价层电子对互斥理论,ClO3-的空间构型是三角锥形,中心原子氯的杂化形式为sp3。
(4)由碳酸盐的热分解示意图看出,CaCO3热分解生成CaO,SrCO3热分解生成SrO,CaO和SrO都是离子晶体,因为离子半径r(Ca2+)<r(Sr2+),CaO晶格能大于SrO晶格能,故CaCO3更易分解为CaO,所以CaCO3的热分解温度低于SrCO3。CO2分子结构为O=C=O,C=O双键中1条σ键,1条π键,所以CO2分子内的化学键类型有σ键、π键。
(5)萤石的化学式为CaF2,即晶胞中钙离子与氟离子个数比为1:2,从晶胞示意图看,每个晶胞中实际占有黑球的个数=8×![]() +6×
+6×![]() =4,晶胞中实际占有白球的个数为8,据此可知黑球代表Ca2+,白球代表F-。将该面心立方晶胞分割成8个小立方体(
=4,晶胞中实际占有白球的个数为8,据此可知黑球代表Ca2+,白球代表F-。将该面心立方晶胞分割成8个小立方体(![]() ),每个小立方体的4个顶点上是Ca2+,体心是F-,现选取一个顶点(Ca2+)作为考查对象,经过该顶点的小立方体有8个,即与该顶点的Ca2+距离相等且最近的F-共有8个,所以Ca2+的配位数为8。萤石的一个晶胞中实际占有4个Ca2+和8个F-,所以萤石一个晶胞的离子数为12。1个Ca2+的质量=
),每个小立方体的4个顶点上是Ca2+,体心是F-,现选取一个顶点(Ca2+)作为考查对象,经过该顶点的小立方体有8个,即与该顶点的Ca2+距离相等且最近的F-共有8个,所以Ca2+的配位数为8。萤石的一个晶胞中实际占有4个Ca2+和8个F-,所以萤石一个晶胞的离子数为12。1个Ca2+的质量=![]() =
=g,1个F-的质量=
![]() =
=![]() g,则萤石的密度ρ=
g,则萤石的密度ρ=![]() =
=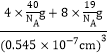 =
=![]() g/cm3。
g/cm3。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
